Коррозия и защита металлов от коррозии
8.1 Классификация видов коррозии
8.2 Защита от коррозии
Технически нецелесообразное разрушение металлов под воздействием внешней среды называется коррозией. Причиной коррозии металлов является их термодинамическая неустойчивость, т.е. возможность самопроизвольного перехода металла в более устойчивое окисленное состояние, в котором он встречается в природе. Химическая энергия реакции коррозионного разрушение металлов выделяется в виде теплоты и рассеивается в окружающем пространстве. Коррозионные процессы протекают необратимо в соответствии со вторым началом термодинамики и являются окислительно-восстановительными процессами.
Убытки от коррозии делятся на: а) прямые, т.е. стоимость металла, подвергшегося коррозионному разрушению; б) косвенные, которые значительно могут превышать прямые потери.
К убыткам от коррозии можно отнести стоимость потерянного продукта, например, газа, нефти, масла через прокоррозировавшие трубы, экологический урон и т.д. Ежегодные потери от коррозии исчисляются многими миллиардами рублей.
Классификация видов коррозии
По условиям протекания различают следующие виды коррозии:
1) газовая (при высоких температурах);
2) коррозия в неэлектролитах (органических средах, не проводящих электрический ток);
3) атмосферная коррозия в естественной атмосфере воздуха;
4) коррозия в электролитах (кислотная, щелочная, солевая, морская, в расплавах);
5) почвенная коррозия (ржавление подземных трубопроводов);
6) структурная коррозия из-за структурной неоднородности металла;
7) биокоррозия при участии продуктов, выделяемых микроорганизмами;
8) радиационная коррозия;
9) контактная коррозия, вызванная контактом металлов, имеющих разные потенциалы в данном электролите;
10) коррозионная кавитация – разрушение металла при одновременном коррозионном и ударном воздействии внешней среды (разрушение лопаток гребных винтов морских судов).
По характеру коррозионного разрушения (по геометрии) различают:
1. Сплошная или общая коррозия, ее условно подразделяют на:
а) равномерная, она протекает примерно с одинаковой скоростью по всей поверхности металла;
б) неравномерная – протекает с неодинаковой скоростью на различных участках поверхности металла;
в) структурно-избирательная коррозия, при которой разрушается преимущественно одна структурная составляющая сплава (обесцинкование латуни).
2. Местная коррозия, охватывающая лишь некоторые участки поверхности металла:
а) пятнами (латунь в морской воде);
б) язвами (коррозия стали в грунте);
в) точечная (питтинг) точек 0,1-2 мм (нержавеющая сталь в морской воде);
г) сквозная (сквозное разрушение металла);
д) подповерхностная начинается с поверхности, но распространяется под поверхностью (луженое железо);
е) межкристаллитная (интеркристаллитная) коррозия распространяется оп границам кристаллов. Этот вид особенно опасен, т.к. ведет к быстрой потере прочности и пластичности.
По механизму протекания коррозионного процесса как окислительно-восстановительного, зависящему от характера внешней среды различают:
а) химическую коррозию;
б) электрохимическую коррозию.
Скорость коррозии зависит от: характера среды, состояния поверхности, температуры и других факторов.
Химическая коррозия
При химической коррозии металл разрушается за счет химической реакции в средах, не проводящих электрический ток. Это коррозия в газах и парах при высокой температуре в отсутствии влаги (газовая коррозия) или в жидкостях, не проводящих электрического тока (в неэлектролитах). Химическая коррозия возможна, если DG<0.
Химическую коррозию в атмосфере кислорода в общем виде можно представить как:
nMe + 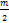 O2 = MenOm.
O2 = MenOm.
Скорость окисления металла зависит от скорости собственно химической реакции и скорости диффузии окислителя через окисную пленку. Защитное действие пленки тем выше, чем лучше ее сплошность и ниже диффузионная способность.
Сплошность пленки на поверхности металла оценивается фактором Пиллинга-Бедвордса – VOX/VМе, где VOX – объем образовавшегося оксида; VМе – объем металла, израсходованного на образование этого оксида.
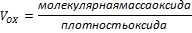

Если VOX/VМе<1, пленка не может быть сплошной и защищать металл от коррозии. Такая закономерность наблюдается для щелочных и щелочноземельных металлов. Отмечается линейный закон роста пленки:
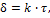
где d – толщина пленки; k – константа; t – время образования окисной пленки.
Если VOX/VМе>1, то пленка сплошная, коррозия будет тормозиться диффузией реагентов через пленку и по мере утолщения оксида рост ее будет замедляться. В этом случае рост пленки соответствует параболическому закону
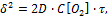
где D – коэффициент диффузии; С[О2] – концентрация кислорода.Характерно для таких металлов как Fe, Co, Ni, Mn, Ti.
Для таких металлов как Al, Zn, Cr установлена логарифмическая зависимость роста пленки во времени (12.5) и VOX/VМе>1 пленки тонкие, сплошные.
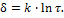
В зависимости от температуры для одного и того же окисляющегося металла могут проявляться различные законы роста оксидной пленки.При химической коррозии окисление и восстановление происходят одновременно, в одну стадию без «территориального» разделения.
Электрохимическая коррозия
подчиняется законам электрохимической кинетики гетерогенных реакций. Она протекает в средах, проводящих электрический ток: во влажной атмосфере с растворенными в ней газами, в растворах электролитов; в почве и расплавах солей. Термодинамическая возможность электрохимической коррозии с кислородной и водородной деполяризацией определяется прежде всего электрохимической диаграммой воды и наличием гальванической пары элементов.
Согласно теории микрогальванопар, причиной электрохимической коррозии металлов является наличие на их поверхности микроскопических короткозамкнутых гальванических элементов, возникающих вследствие неоднородности металла и его контакта с окружающей средой. В отличие от специально изготовляемых в технике гальванических элементов они возникают на поверхности металла самопроизвольно.
Электрохимическое растворение металла состоит из трех основных стадий:
1) анодного процесса
Ме – nе– = Меn
перехода ионов коррозирующего металла в раствор под влиянием гидратации (сольватации) с освобождением электронов;
2) омического процесса – перетекания освободившихся электронов от анодных участков к катодным (поляризация);
3) катодного процесса – ассимиляции освободившихся электронов каким-либо деполяризатором, находящимся в растворе.
На анодном участке, потенциал которого электроотрицательнее, происходит растворение металла:
Меn+ + n  +mH2O = Men+·mH2O + n
+mH2O = Men+·mH2O + n 
Часть освободившихся электронов перейдет с анода на катод. Происходит поляризация электродов в результате чего jК и jА сближаются, что препятствует протеканию коррозионного процесса. Однако в растворе всегда имеются ионы или вещества (деполяризаторы), которые способны отводить электроны с катодных участков. Процесс отвода электронов, с катодных участков называется деполяризацией. Следовательно, электрохимическая коррозия может протекать, если электроны с анодных участков постоянно перетекают на катодный, а с катодного удаляются деполяризаторами.
Очень часто электрохимическая коррозия возникает в результате различной аэрации, т.е. неодинакового доступа кислорода воздуха к отдельным участкам поверхности металла. При коррозии железа под каплей электролита около ее краев, куда кислороду легче проникнуть будет катодный участок, а в центре капли, где толщина капли больше и О2 проникнуть труднее – анодный участок – происходит разрушение металла.
Электрохимическая коррозия особенно опасна при контакте металлов с резко отличающимися значениями электродных потенциалов. Скорость коррозии пропорциональна разности потенциалов окислителя и металла (ЭДС). Чем больше ЭДС, тем больше напряжение и ток, тем больше масса металла будет корродировать согласно закону Фарадея.
Процесс отвода электронов с катодных участков называетсядеполяризацией. Вещества, при участии которых осуществляется деполяризация, называются деполяризаторами. На практике чаще всего приходится встречаться с двумя типами деполяризации:водороднойикислородной. Тип деполяризации (катодный процесс) зависит отреакции средыраствораэлектролита.
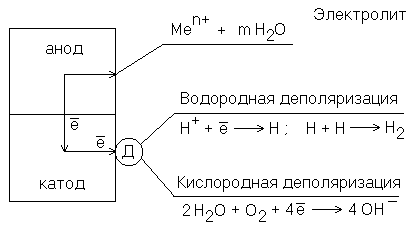
Рис. 8.1. Схема электрохимической коррозии. (Д – деполяризатор)
Процесс отвода электронов с катодных участков называетсядеполяризацией. Вещества, при участии которых осуществляется деполяризация, называются деполяризаторами. На практике чаще всего приходится встречаться с двумя типами деполяризации:водороднойикислородной. Тип деполяризации (катодный процесс) зависит отреакции средыраствораэлектролита.
Вкислой средеэлектрохимическая коррозия протекает сводородной деполяризацией. Рассмотрим коррозию железной пластинки с примесями меди во влажнойхлористоводородной атмосфере. В этом случае железо будет анодом (E= –0,44В), а медь – катодом (E°= +0,34В). На анодном участке будет происходить процесс окисления железа, а на катодном – процесс деполяризации ионами водорода, которые присутствуют в электролите:
А:Fe– 2  →Fe2+– окисление
→Fe2+– окисление
К:2H++ 2  →H2– восстановление
→H2– восстановление
Схема возникающего короткозамкнутогогальванического элементавыглядит следующим образом:
Fe|HCl|Cu
Внейтральной и щелочной средахкоррозия протекает скислородной деполяризацией, т.е. роль деполяризатора выполняет кислород, растворенный в воде. Этот вид коррозии наиболее широко распространен в природе: он наблюдается при коррозии металлов в воде,почвеи в незагрязненной промышленными газами атмосфере. Если коррозии во влажном воздухе подвергается железо с примесями меди, то электродные процессы можно записать в виде:
АFe– 2  →Fe2+– окисление
→Fe2+– окисление
К2H2O + O2+4  →4OH–– восстановление
→4OH–– восстановление
Схема короткозамкнутого гальванического элемента:
Fe|H2O, O2|Cu.
У поверхности металла в электролите протекают следующие реакции:
Fe2++ 2OH–→Fe(OH)2
4Fe(OH)2+ O2+ 2H2O→4Fe(OH)3
Основная массачерных металловразрушается вследствие процесса ржавления, в основе которого лежат вышеуказанные реакции.
Коррозия металла в результате неравномерного доступа кислорода. Случаиэлектрохимической коррозии, возникающей вследствие неравномернойаэрациикислородом различных участков металла, очень часто встречаются в промышленности и в подземных сооружениях. Примером может служить коррозия стальной сваи, закопанной в речное дно (рис 8.2).
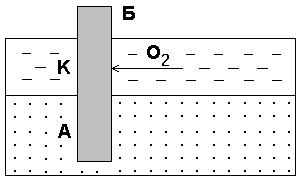
Рис. 8.2. Коррозия в результате неравномерного доступа кислорода. Б – техническое сооружение;А – анодный участок;К– катодный участок.
Часть конструкции, находящаяся в воде, омывается растворенным в ней кислородом и, в случае возникновения условий дляэлектрохимической коррозии, будетвыполнять ролькатода. Другая же часть конструкции, находящаяся в почве, будетанодоми подвергнется разрушению.
Защита от коррозии
Причины, вызывающие коррозионные разрушения, многочисленны. Соответственно, разнообразны и методы защиты. Основная схема электрохимической коррозии диктует и методы защиты:
1) обработка внешней (коррозионной) среды;
2) защитные покрытия;
3) электрохимическая защита;
4) изготовление специальных коррозионно-устойчивых сплавов (легирование);
5) рациональное конструирование.
Методы защиты нужно рассматривать, исходя из основной схемы электрохимической коррозии.
1. Сущность метода обработка внешней среды заключается в удалении или понижении активности веществ, способствующих коррозии:
а) нейтрализации кислых сред, вызывающих коррозию за счет водородной деполяризации;
б) деаэрации – удаление О2 осуществляется кипячением воды,
в) продуванием воды инертным газом,
г) введением в воду восстановителей,
д) добавлением ингибиторов коррозии в раствор.
В качестве ингибиторов в воде и водных растворах применяются некоторые окислители–пассиваторы: нитраты, хроматы, бихроматы, персульфат натрия и пленкообразователи (фосфаты, амины). Замедлители атмосферной коррозии подразделяются на нелетучие (контактные) и летучие (парофазные). Ингибиторы избирательно адсорбируются на анодных или катодных участках и блокируют эти участки, тем самым замедляя или прекращая коррозию. По механизму воздействия ингибиторы разделяются на анионные, катионные и неионогенные.
2.Защитные покрытия. Роль защитных покрытий сводится к изоляции металла от воздействия внешней среды. Покрытия делят на металлические и неметаллические.
Металлические покрытия, они подразделяются на анодные и катодные. К катодным покрытиям относятся покрытия, потенциал которых в данной среде имеет более положительное значение, чем потенциал основного металла, например, луженое железо (рис. 8.3, б):
j0Sn = –0,14 В,j0Fe= –0,44 В.
А:Fe – 2  ® Fe2+
® Fe2+
К:2H2O + O2 + 4  ®4OH–
®4OH–
Идет разрушение металла-изделия.
У анодного покрытия j покрывающего металла более отрицателен, чем основного (защищаемого) Ме (рис. 8.3, а).
j0Zn = –0,76 В; j0Fe = –0,44 В.
А: Zn – 2  ®Zn0
®Zn0
К: 2H2O + O2 + 4  ® 4OH–
® 4OH–
Пока защитный слой полностью изолирует основной металл от окружающей среды, принципиального различия между катодными и анодными покрытиями нет. При нарушении целостности анодное покрытие разрушается, а изделие – нет.
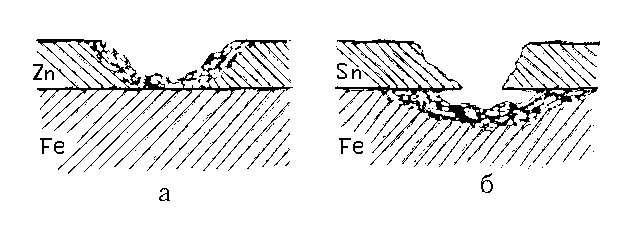
Рис. 8.3. Коррозия железа при нарушении металлических покрытий:
а – оцинкованное (анодное покрытие); б – луженое (катодное покрытие).
Кроме того, к металлическим покрытиям относятся также покрытия, полученные металлизацией – на защищаемое изделие с помощью сжатого воздуха распыляется расплавленный другой металл. Возможность нанесения покрытия на собранные конструкции и хорошее сцепление с основой дает этот метод.
Термодиффузионные покрытия – этот способ широко используется для получения жаростойких покрытий (алитирование, хромирование, титанирование). Изделие помещают в смесь, содержащую порошок покрытия. При высоких температурах происходит диффузия наносимого металла в основной металл-изделие.
Плакирование – покрытие сплава чистым металлом. Толщина плакирующего слоя не превышает 5-10% от толщины сплава.
Воронение – нанесение на сталь оксидных пленок горячим раствором (NaOH + NaNO3) и образование пленки Fe3O4 (FeO, Fe2O3) цвета «воронова крыла».
Фосфатирование – образование фосфатной пленки на стали. Изделие при 95-98 ºС погружают в 3% раствор «мажефа» (Mn(H2PO4)2 и Fe(H2PO4)2) выдерживают в этом растворе до прекращения выделения Н2 с последующей кристаллизацией фосфатов Fe и Mn в виде черного осадка.
Анодирование – Al и Ti и других вентельных металлов с образованием оксидной пленки.
Неметаллические покрытия делят на органические и неорганические. К неорганическим относят эмали, бетонные и цементные покрытия. Органические покрытия: лаки, краски, эмали на основе органических полимеров; гуммирование – нанесение на металл сырой резины с последующей вулканизацией и образованием покрытия на металле.
3. Метод электрохимической защиты основан на торможении анодных или катодных реакций коррозионного процесса.
Уменьшение или полное прекращение коррозии достигается созданием на защищаемом изделии высокого электроотрицательного потенциала.
а) протекторная защита – защищаемое изделие соединяют с металлом, имеющим высокий электроотрицательный потенциал.Протектор является анодом и растворяется, защищаемое изделие – катод. Например, корпус морского корабля (сталь) – протектор может быть Al, Mg, Zn.
А.:Mg – 2  ®Mg2+
®Mg2+
К.:2H2O + O2 + 4  ®4OH–
®4OH–
б) катодная защита – защищаемое изделие подключается к отрицательному полюсу внешнего источника тока, он становится катодом, а анодом служит вспомогательный металлический электрод. Анод растворяется, на защищаемом изделии (катоде) выделение Н2:
А.:Ме – n  ®Men+;
®Men+;
К.:2H+ + 2  ®H2.
®H2.
Коррозию подземных сооружений вызывают так называемые «блуждающие токи». Они обусловлены утечкой постоянного тока с рельсов электрического транспорта в землю. Место входа «блуждающего тока» в подземное металлическое сооружение является катодом, а место выхода из него – анодом. Для защиты от коррозии находят анодный участок методом дренажа и соединяют его с источником «блуждающего тока» (трамвайным рельсом), тогда весь ток проходит по этому проводнику и коррозия не происходит.
4. Изготовление специальных коррозионноустойчивых сплавов (легирование). Легирование – это введение при выплавке основного металла коррозионноустойчивых компонентов, вызывающих пассивацию металла. Сталь легируют: Cr, Mo, Ni, Co и другими металлами. Легирующие компоненты добавляются согласно правила Таммана – порог коррозионной устойчивости кратен 1/8 атомной доли легирующего компонента.
5. Рациональное конструирование. При конструировании важно предвидеть контактирующие детали металлического сооружения, которые могут подвергнуться интенсивной коррозии. В многоэлектродном элементе разделение на катод и анод не столь однозначно, как у двухэлектродных систем и полярность электродов может изменяться в зависимости от условий. Важно отметить, что железо, как основной металл, подвергающийся коррозии, необходимо «сделать» катодом.
Итак, коррозию металла можно затормозить или даже прекратить. Выбор способа защиты определяется его эффективностью, а также экономической целесообразностью.
Вопросы для самоконтроля
1. Дать определение коррозии. Назвать основные причины возникновения коррозии.
2. Как различить коррозионные процессы по механизму протекания?
3. Объяснить механизм электрохимической коррозии.
4. Что определяет скорость гальванокоррозии с водородной деполяризацией?
5. Что определяет скорость гальванокоррозии с кислородной деполяризацией?
6. Какие причины вызывают перенапряжение в электродных процессах?
Тема 9
