Одноосновні карбонові кислоти. жири
Одноосновними карбоновими кислотами називають похідні вуглеводнів, у яких один атом Гідрогену заміщений на карбоксильну групу – COOН. У цій складній функціональній групі з'єднані дві прості оксигеновмісні групи: карбонільна >С=О і гідроксильна – ОН. Число карбоксильних груп визначає основність кислот. Залежно від характеру вуглеводневого залишку розрізняють насичені, ненасичені й ароматичні карбонові кислоти. Загальна формула гомологічного ряду насичених одноосновних карбонових кислот – C nH2n+1COOH.
Для одноосновних карбонових кислот найуживаніші тривіальні назви, які здебільшого походять із природних джерел першого отримання кислот. За раціональною номенклатурою гомологи кислот розглядаються як похідні оцтової кислоти і називаються за найменуваннями залишків із доданням слів "оцтова кислота". За систематичною номенклатурою IUPAC назви кислот складаються з назв вуглеводнів із тим самим числом атомів Карбону, що і кислоти, із доданням закінчення -ова і слова "кислота".
Залишок будь-якої карбонільної кислоти R–CO–, що уторився при відніманні гідроксильної групи карбоксилу, називається кислотним, або ацильним залишком.
Карбонові кислоти добувають: за. допомогою реакцій (окислення первинних спиртів, альдегідів, олефінів, кетонів; реакцією омилення тригалогенозаміщених похідних, нітрилів, амідів, естерів, ангідридів; реакцій з металоорганічними сполуками й оксосинтезу.
Фізичні властивості кислот залежать від їх складу і будови. За збільшення молекулярної маси розчинність кислот у воді й густина зменшуються, а температура кипіння – збільшується. Кислоти з непарним числом атомів Карбону плавляться при меншій температурі, ніж ближчі кислоти з парним числом атомів Карбону. В етанолі й діетиловому естері кислоти розчинні. Молекули їх асоційовані. У водному розчині кислоти дисоційовані на іони. Під впливом карбонільної групи рухливість атому Гідрогену в гідроксилі настільки збільшується, що він здатний до відщеплення від молекули кислоти у вигляді протона. Це пояснюється зміщенням електронної густини під впливом атома Оксигену карбоксильної групи. Зв'язок між Гідрогеном і атомом Оксигену гідроксильної групи слабкий і відщеплення атома Гідрогену у вигляді йона полегшується:
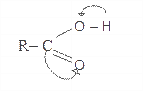
Хімічні властивості одноосновних карбонових кислот зумовлені властивостями карбоксильної групи і зв'язаного з нею вуглеводневого залишку, а також їх взаємним впливом. Усі реакції, що в них вступають кислоти, поділяються на чотири групи:
реакції атома Гідрогену в карбоксилі;
реакції гідроксильних груп;
реакції зв'язаного з карбоксилом вуглеводневого залишку;
реакції карбоксильних груп у цілому.
Карбонові насичені кислоти легко утворюють солі, ангідриди, хлорангідриди, аміди, нітрили, естери і взаємодіють із галогенами, які заміщують атоми Гідрогену залишку, що знаходиться в a-положенні до карбоксильної групи. Ненасичені кислоти, крім того, здатні до реакцій приєднання, окислення і полімеризації.
Органічні сполуки, які у своєму складі мають дві карбоксильні групи, називаються двохосновними карбоновими кислотами, або дикарбоновими. Розрізняють насичені, ненасичені й ароматичні карбонові кислоти. Двохосновні карбонові кислоти мають історичні назви – щавлева, малонова, бурштинова, глутарова, адипінова і т.п. За систематичною номенклатурою IUPAC назви кислот складаються з назв вуглеводнів із тим самим числом атомів Карбону, враховуючи атоми Карбону обох карбоксильних груп, із доданням закінчення -діова та слова "кислота".
Насичені двохосновні карбонові кислоти добувають окисленням гліколей, омиленням динітрилів, через магнійорганічні сполуки; з одноосновних карбонових кислот, за допомогою малонового й ацетооцтового естерів.
За хімічними властивостями двохосновні кислоти аналогічні одноосновним. Завдяки наявності двох карбоксильних груп, вони утворюють два ряди похідних, залежно від того одна чи дві карбоксильні групи вступають у реакцію. Вони утворюють кислі й середні солі, естери, аміди, ангідриди, нітрили, а деякі з них здатні декарбоксилуватися (цис-, трансформи).
Найпростіші ненасичені двохосновні карбонові кислоти – фумарова й малеїнова, які є геометричними ізомерами.
Амідами кислот називаються похідні карбонових кислот, у яких гідроксил карбоксилу заміщений на аміногрупу. Двохосновні карбонові кислоти утворюють повні й неповні аміди. Важливим представником класу амідів є повний амід карбонової кислоти – сечовина, кінцевий продукт нітрогенного обміну в організмі людини й тварин. За добу із сечею людини виділяється до 30 г сечовини – твердої кристалічної речовини, добре розчинної у воді (дає нейтральне середовище) і такої, що гідролізує. Сечовина утворює солі з одним еквівалентом кислоти, під час нагрівання розкладається, перетворюючись у біурет.
Лабораторна робота № 7
