Реакции от концентрации реагирующих веществ
Зависимость скорости химической реакции от концентраций реагирующих веществ объясняется тем, что для прохождения реакции требуется столкновение реагирующих молекул, а частота таких столкновений будет тем больше, чем выше их концентрация.
Выведенное на основе экспериментальных данных уравнение, выражающее зависимость скорости от концентраций реагирующих веществ, показывает, чтоскорость химической реакции пропорциональна произведению концентраций реагентов в степенях, называемых порядками реакции по реагентам и определяемых опытным путем.
Уравнение, устанавливающее зависимость скорости от концентрации реагирующих веществ, называется дифференциальным кинетическим уравнением реакции.
Например, для реакции аА + bB = cC + dD выражение для скорости реакции будет иметь следующий вид:
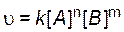 , , | (4.3) |
где k – коэффициент пропорциональности, называемый константой скорости реакции; [A] и [B] – молярные концентрации реагирующих веществ; n и m – показатели степеней при концентрациях реагентов (порядки реакции по веществам А и B).
Общим порядком, или просто порядком реакции, называется величина, равная сумме показателей степеней при концентрациях реагентов в кинетическом уравнении реакции (n+m). Порядок реакции равен сумме порядков по реагирующим веществам.
Константа скорости k – постоянная величина (при T = const) и не зависит от концентрации реагентов. Она определяется природой реагирующих веществ и зависит от температуры.
Из уравнения (4.3) следует, что при единичных концентрациях реагирующих веществ (например, [A]=[B]=1 моль/л) константа скорости реакции численно равна скорости реакции. Размерность константы скорости реакции зависит от порядка реакции. Единицу измерения константы скорости реакции определяют из анализа размерностей.
Порядок реакции зависит от ее сложности.
Для простой (элементарной) реакции стехиометрическое уравнение передает механизм процесса, стехиометрические коэффициенты уравнения реакции совпадают с порядками по реагентам, молекулярность совпадает с общим кинетическим порядком.
Для необратимой элементарной реакции зависимость скорости от концентрации реагентов выражается законом действующих масс.
При постоянной температуре скорость элементарной химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам.
Закон действующих масс справедлив только для элементарных реакций. В большинстве случаев реакции многостадийны. Для сложных (многостадийных) реакций порядки реакции по реагентам не совпадают со стехиометрическими коэффициентами, общий порядок реакции не равен сумме стехиометрических коэффициентов. Порядок сложной реакции может быть целым, дробным числом и даже равным нулю. Порядок сложной реакции определяют экспериментально.
