Химическая и электрохимическая коррозия
По механизму протекания различают химическую и электрохимическую коррозию. Химическая коррозия происходит в том случае, когда окисление металла и восстановление деполяризатора происходят при их непосредственном контакте. Этот механизм реализуется в сухих газах, жидкостях, не проводящих электрический ток. Гораздо чаще встречается второй вид - электрохимическая коррозия (ЭХК).
ЭХК проходит в присутствии токопроводящей среды (например, раствора электролита), при этом процессы окисления металла (анодный процесс) и восстановления деполяризатора (катодный процесс) пространственно удалены друг от друга. В разультате механизм ЭХК аналогичен процессу, протекающему в короткозамкнутых гальванических элементах. Для того чтобы коррозия осуществлялась по электрохимическому механизму, необходимо выполнение двух условий: наличия токопроводящего слоя раствора электролита и разности потенциалов на корродирующей поверхности. Первое условие реально встречается очень часто (на поверхности металла практически всегда есть хотя бы тонкий слой влаги). Второе условие также реализуется практически всегда: в реальных условиях корродируют технические металлы, содержащие различные металлические и неметаллические примеси (наибольшая разность потенциалов возникает при контакте разных металлов). Пару металлов (М1 и М2), находящуюся в среде электролита, называют гальванопарой и обозначают М1 / М2.
Анодный процесс происходит на участках изделий с меньшим потенциалом в данной среде. Анодные участки корродируют (разрушаются).
Катодный процесс происходит на участках изделий с большим потенциалом в данной среде. Катодные участки химически не изменяются. Они служат проводниками электронов от анодных участков к окислителю, чем усиливают коррозию анодных участков.
Коррозию с участием наиболее распространённых окислителей - растворённого кислорода или ионов водорода соответственно называют коррозией с кислородной или водородной деполяризацией.
Пример. Рассмотрим процессы, происходящие при нарушении сплошности оцинкованного покрытия железа (точнее, углеродистой стали) во влажном воздухе.
Решение. При нарушении сплошности покрытия образуется гальванопара Zn/Fe, основные окислители во влажном воздухе – вода и кислород. Рассмотрим процесс коррозии с кислородной деполяризацией:
· Выписываем потенциалы металлов в нейтральной среде из табл. 4: 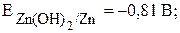
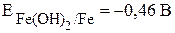 .
.
· Анодный участок гальванопары - металл с меньшим потенциалом, цинк. Цинк является восстановителем в процессе коррозии.
· Катодный участок гальванопары - металл с более высоким значением потенциала (Fe). На его поверхности происходит восстановление окислителя.
· Окислитель при коррозии с кислородной деполяризацией - кислород, 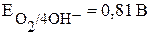 (табл. 4).
(табл. 4).
· 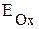 >
> 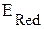 ., коррозия возможна.
., коррозия возможна.
· Составляем уравнение процесса коррозии, пользуясь методом электронно-ионных полуреакций (с. 25, раздел 6.2):
 2
2 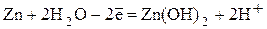 - анодный процесс
- анодный процесс

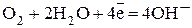 - катодный процесс (на Fe)
- катодный процесс (на Fe)

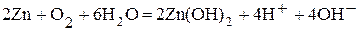 .
.
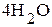
· Молекулярное уравнение: 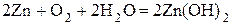 . Направление перемещения электронов в системе: ē
. Направление перемещения электронов в системе: ē
 ,0
,0
 (а) Zn / Fe (к) ē
(а) Zn / Fe (к) ē
H2O + O2
