Відносне зниження тиску насиченої пари розчинника над розчином нелеткої речовини дорівнює молярній частці розчиненої речовини.
Залежність тиску насиченої пари над розчином від його концентрації установив французький учений Ф. М. Рауль, тому пов'язані між собою рівняння та відповідні формулювання називають першим законом Рауля.
Слід зазначити, що зниження тиску насиченої пари над розчином залежить тільки від числа частинок (молів) розчиненої речовини і не залежить від її властивостей (маси частинок, їхніх розмірів, хімічної природи та ін.).
Прямим наслідком зниження тиску насиченої пари над розчинами є зростання температур їх кипіння і зниження температур кристалізації.
Як уже зазначалося, рідина починає кипіти, коли тиск її насиченої пари досягає зовнішнього (атмосферного) тиску. Залежність тиску насиченої пари над розчинником виражає крива ОА. Аналогічна крива для розчину нелеткої речовини в рідині ( крива DE) згідно з першим законом Рауля лежить нижче від кривої ОА, Температура кипіння рідкого розчинника (вихідної рідини) за атмосферного тиску відповідає Т°кт. За цієї температури розчин не кипітиме, бо тиск його насиченої пари нижчий від атмосферного. Щоб тиск насиченої пари над розчином досягнув атмосферного, розчин требапідігріти до температури Ткип .
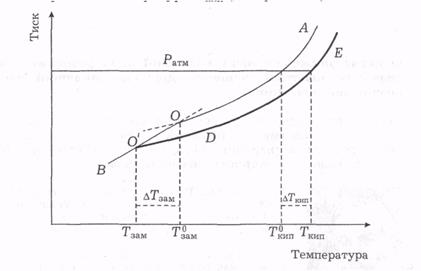
Різницю (Ткип - Т°ип) = ∆ТКИП називають підвищенням температури кипіння розчину. Якщо взяти розчин з вищою концентрацією розчиненої речовини, то тиск його насиченої пари буде ще нижчим, а температура кипіння відповідно зросте на ще більшу величину. Зниження тиску насиченої пари розчину визначається молярною часткою розчиненої речовини, тому й підвищення температури кипіння ∆ТКИП розчину пропорційне числу молів розчиненої речовини в певній кількості розчинника:
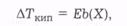
де b(Х) — моляльна концентрація розчиненої речовини, тобто число її молів в 1 кг розчинника.Фізичний зміст коефіцієнта пропорційності Е можна з'ясувати, прийнявши змінну величину b(Х) за одиницю, тобто 1 моль/кг. За цієї умови АТКИП = Е, тобто Е — це підвищення температури кипіння одномоляльного розчину. Ф. М. Рауль довів, що розчини різних речовин з однаковою моляльною концентрацією в одному й тому самому розчиннику мають однакові значення ∆ТКИП. Отже, ∆ТКИП (і, відповідно, значення Е) не залежить від природи розчиненої речовини. Проте розчинам однієї й тієї самої речовини в різних розчинниках з однаковою моляльною концентрацією розчиненої речовини b(Х) відповідають різні значення ∆ТКИП.
Отже, можна дійти висновку, що константа Е залежить від природи розчинника і тому її називають ебуліоскопічною сталою розчинника. Наприклад, для води, бензолу й оцтової кислоти значення ебуліоскопічної сталої відповідно дорівнюють 0,516, 2,57 і 3,10 К • кг/моль.
Під час охолодження розбавленого розчину кристалізація розпочинається з появи кристалу розчинника, який перебуває в рівновазі з рідким розчином. Наприклад, у разі охолодження розбавлених водних розчинів речовин утворюються кристали льоду. Рівновага між рідкою і твердою фазами встановлюється, коли тиск насиченої пари над ними однаковий. Для розчинника така рівновага встановлюється в потрійній точці. Потрійній точці відповідає температура температура замерзання рідкого розчинника.
Проте рідкий розчин за цієї температури не перебуватиме в рівновазі з твердою фазою, оскільки тиск насиченої пари над цими фазами неоднаковий. Ця умова виконується в точці перетину кривих ВО і DE (О1), що відображають залежності тиску насиченої пари від температури відповідно над твердим розчинником (наприклад, льодом) і над розчином. Точка О' зміщена в бік нижчих температур відносно точки О, .тобто розчин замерзає за температури Тзам нижчої за температуру замерзання розчинника. Різниця (T°-Тзам), яку позначають ∆Тзам, називають зниженням температури замерзання розчину.
Зі збільшенням концентрації розчину тиск насиченої пари над ним дедалі знижується, відповідно зміщується в бік нижчих температур і точка замерзання розчину, тому
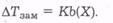
Коефіцієнт пропорційності К відповідає зниженню температури замерзання розчину за b(Х) = 1 моль/кг. Вивчаючи температури замерзання розчинів, що містили різні розчинені речовини в одному й тому самому розчиннику та одну й ту саму розчинену речовину в різних розчинниках, Ф. М. Рауль дійшов висновку, що величина К не залежить від природи розчиненої речовини, але є різною для різних розчинників, тому її було названо кріоскопічною (від грецьк. крио — холод) сталою розчинника. Наприклад, для води, бензолу та оцтової кислоти кріоскопічні сталі К дорівнюють відповідно 1,86, 5,12 і 3,90 К • кг/моль.
Проаналізувавши рівняння , можна дійти висновку, що ∆ТКИП і ∆Тзам пропорційні числу молів розчиненої речовини. Оскільки кожен моль містить однакове число молекул (6,022 • 1023), то ці властивості розчинів залежать тільки від числа частинок розчиненої речовини. Отже,
