Описание физико-химических свойств анилина
| Этиловый спирт (С2Н5ОН, этанол, винный спирт) – бесцветная прозрачная летучая жидкость плотностью 0,813 – 0,816 г/см3 с характерным запахом и жгучим вкусом. Этанол легко воспламеняется, горит не коптящим мало светящимся пламенем. Коэффициент растворимости паров этанола в воде при 400С составляет 1412, а в крови человека – от 1380 до 1580 (при 370С). Обладает высокой гигроскопичностью, смешивается с водой, эфиром и другими органическими растворителями во всех соотношениях. Температура кипения этанола 77 – 78,50С. Широко применяется в химической промышленности в качестве растворителя и одного из исходных продуктов для органического синтеза, а также в качестве добавки в бензины и другие моторные топлива для повышения их энергетических свойств и снижения концентрации вредных веществ в выхлопных газах. Получают этиловый спирт из крахмалсодержащих продуктов (хлебные злаки, овощи и др.) путем их брожения, либо синтетически. При брожении ферментация заканчивается, когда концентрация спирта достигает примерно 12 – 14 % объема. В сыром виде спирт содержит ядовитые примеси, образующиеся в процессе его изготовления. Токсические эффекты этанола затрагивают деятельность многих функциональных систем. Одной из самых серьезных проблем в обществе является так называемая медицинская проблема острой и хронической алкогольной интоксикации, абстиненции и их осложнений. Смертельные отравления наступают после приема больших количеств алкогольных напитков однократно или в течение короткого промежутка времени (до 6 – 7 ч). Средняя смертельная доза этилового спирта находится на уровне 4 – 12 г/кг. Для выражения массовой доли этанола необходимо показатель градусов алкоголя (то есть его объемную концентрацию) умножить на плотность спирта, равную 0,79384 г/см3. Подобные пересчеты используются для определения концентрации этанола в крови в ходе экспертизы степени тяжести опьянения. С целью стандартизации расчета концентрации этанола в крови человека в США и Западной Европе введено понятие “стандартного приема” – количество спиртного, содержащего 13,6 г этанола, принятого однократно одним человеком. Наиболее распространенными единицами измерения количества этанола являются мг % (миллиграмм проценты) и мМ/л (миллимоль на литр). Для пересчета мг % в мМ/л следует количество мг % умножить на коэффициент 0,2171; соответственно для преобразования мМ/л в мг % количество мМ/л делят на 0,2171. 1.3. Определение теоретического количества воздуха, необходимого для горения исследуемого вещества (только ГЖ); |
1.Уравнение материального баланса вещества
C2H5OH+3O2+3x3,76N2=2CO2+3H2O+3x3,76N2.
B = 3
2. Молекулярная масса этанола М = 46 м3/кг
3. Расчет объема воздуха необходимого для горения
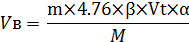
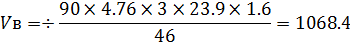
где:
- Vв- теоретическое количество воздуха, необходимое для горения, кмоль/кмоль, м3/кг;
- m- масса вещества, кг;
- b- коэффициент полноты сгорания;
- Vt - теоретическое количество теплоты, необходимое для горения м3/кг;
- a- коэффициент избытка воздуха;
- М- масса одного кмоля вещества, кг/кмоль
Чтобы найти объем воздуха, необходимо найти количество теплоты необходимое для горения.
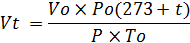
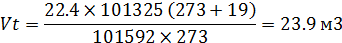
где:
- Vt - теоретическое количество теплоты, необходимое для горения м3/кг;
- V0 – объем 1 моля газа, м3/моль
- P0 – атмосферное давление
- t температура, оС
- P - давление газа, Па
- T0 – температура
