Инетика химических реакций.
Химическое равновесие
Химическая кинетика – учение о скорости и механизме химических реакций.
4.1 Скорость химических реакций
Все химические системы по агрегатному состоянию делятся на гомогенные и гетерогенные.
Система, состоящая из веществ в одинаковом агрегатном состоянии (в одной фазе) является гомогенной. В гомогенных системах нет поверхности раздела между отдельными составными частями, поэтому реакция протекает в однородной среде.
Например: Н2(Г) + Cl2(Г) ↔2HCl(Г).
Гетерогенная система состоит из веществ разных агрегатных состояний, имеет поверхность раздела между отдельными ее частями. Гетерогенные реакции протекают на границе раздела фаз.
Например: С(ТВ) + О2(Г) → СО2(Г)
Количественно скорость химической реакции характеризуется изменением концентраций реагирующих веществ в единицу времени.
4.1.1. Скорость химических реакций в гомогенной системе
Скорость гомогенных реакций равна изменению количества вещества (исходного или продукта) в единицу времени в единице объема реакционного пространства.
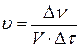 , моль/(л×с),
, моль/(л×с),
где 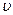 – скорость реакции, моль/(л×с);
– скорость реакции, моль/(л×с);
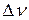 – изменение количества вещества, моль;
– изменение количества вещества, моль;
V – объем, л;
Δτ – изменение времени, с.
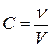 - молярная концентрация, моль/л
- молярная концентрация, моль/л
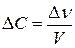 - изменение концентрации, моль/л.
- изменение концентрации, моль/л.
Например, при взаимодействии водорода с парами иода реакция идет по уравнению:
Н2(Г) + J2(Г) ↔2HJ (Г).
Концентрацию паров иода (или водорода) можно определить в начале некоторого отрезка времени, обозначив ее С1 (моль/л) и в конце его – С2 (моль/л), а время соответственно τ1 и τ2 (с). Тогда скорость этой реакции равна:
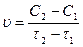
Так как в течение реакции происходит убыль концентрации иода (или водорода), то (С2 – С1)<0. Скорость есть величина положительная, поэтому в выражении скорости ставится знак минус:
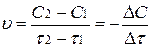 .
.
Скорость реакции можно также определить по увеличению концентрации продукта реакции (HJ) и тогда (С2 – С1)>0 и знак скорости – положительный.
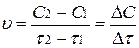 .
.
Приведенные выше выражения изменения концентрации веществ в ходе реакции характеризуют среднюю скорость ее 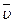 за время Δτ:
за время Δτ:
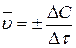 .
.
Истинная (мгновенная) скорость реакции в данный момент времени выражается производной концентрации по времени:
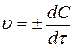 .
.
4.1.2 Скорость химических реакций в гетерогенной системе
Для гетерогенной системы с участием твердого вещества реакция может протекать только на его поверхности. Поэтому концентрация твердого вещества остается постоянной и не входит в выражение скорости реакции.
Так, в реакции горения угля:
С(ТВ) + О2(Г) = СО2(Г) ,
скорость реакции будет иметь вид:
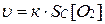 ,
,
где к – константа скорости;
SC – поверхность твердого угля, м2;
[O2] – концентрация кислорода, моль/л.
Но 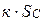 - постоянная величина, так как константа скорости и поверхность твердого вещества постоянны. Обозначив
- постоянная величина, так как константа скорости и поверхность твердого вещества постоянны. Обозначив 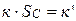 , тогда скорость этой реакции будет иметь вид:
, тогда скорость этой реакции будет иметь вид:
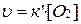 ,
,
т.е. скорость реакции пропорциональна только концентрации кислорода.
4.2 Факторы, влияющие на скорость реакции
Скорость химической реакции зависит от многих факторов. Важнейшими являются: природа, концентрация веществ, температура, катализаторы, давление (для газообразных систем) и т.д.
4.2.1 Концентрация реагирующих веществ
Зависимость скорости реакции от концентрации реагирующих веществ определяется законом действия масс (ЗДМ):
Скорость химической реакции пропорциональна произведению молярных концентраций реагирующих веществ в степенях их стехиометрических коэффициентов.
Так для модельной реакции:
аА + bB ↔ dD + qQ
этот закон выразится уравнениями:
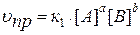
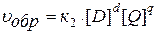 ,
,
где [A], [B], [D], [Q] – молярные концентрации веществ, моль/л;
к1и к2 – константы скорости реакции;
a, b, d, q – стехиометрические коэффициенты.
Константа скорости (к1или к2) не зависит от концентрации, но зависит от природы реагирующих веществ, температуры, катализатора.
Так, при [A] = [B] = 1моль/л константа скорости к1 численно равна скорости реакции:
υ = к1
В этом есть физический смысл константы скорости.
Например, для гомогенной системы:
2 NO(Г) + Cl2(Г)↔2 NOCl(Г)
скорости прямой и обратной реакций определяются выражениями:
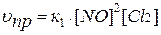
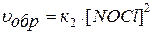 .
.
Для гетерогенной системы:
2 С(ТВ) + О2(Г) ↔ 2 СО(Г)
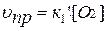
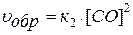 .
.
4.2.2. Давление
В системах, где одно или несколько веществ являются газами, скорость химической реакции зависит от внешнего давления. Например:
Н2(Г) + Cl2(Г) ↔2HCl(Г).
Если увеличить давление на систему в три раза, то во столько раз уменьшится объем и, следовательно, во столько же раз увеличатся концентрации каждого из реагирующих веществ.
Пример 1. Определите, как и во сколько раз изменится скорость прямой реакции
2 NO(Г) + О2(Г)↔2 NO2(Г),
если объем системы уменьшить в 3 раза?
Решение. По ЗДМ скорость прямой реакции будет иметь вид:
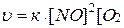 .
.
Обозначив [NO] = x, [O2] = y, получим:
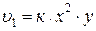 .
.
После уменьшения объема системы, концентрация веществ увеличится в 3 раза. Тогда: [NO] = 3x, [O2] = 3y.
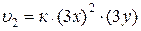 .
.
Разделив 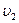 на
на 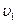 получим изменение скорости:
получим изменение скорости:
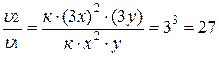 .
.
Скорость реакции возросла в 27 раз.
Пример 2. В системе
СО(Г) + Cl2(Г) ↔ СОСl2(Г)
концентрацию СО увеличили от 0,3 до 1,2 моль/л, а концентрацию Cl2 от 0,5 до 1,45 моль/л. Во сколько раз возросла скорость реакции?
Решение. По ЗДМ скорость этой реакции имеет вид:
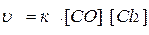 .
.
Начальная скорость (υ1) будет равна:
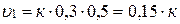
Конечная скорость (υ2) будет равна:
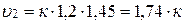 .
.
Разделив υ2 на υ,1 получим:
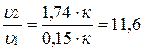 .
.
Скорость реакции возросла в 11,6 раз.
Пример 3. Константа скорости реакции
А + 2В ↔ 2С
равна 0,65 (л)2моль-2с-1. Начальные концентрации веществ (моль/л): А=1,5; В=2,5. В результате реакции концентрация вещества В оказалась равной 0,5 моль/л. Вычислите, какова концентрация вещества А и скорость реакции.
Решение. Находим уменьшение концентрации вещества В.
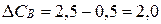 моль/л.
моль/л.
Так как А и В взаимодействуют между собой в отношении 1:2, то концентрация вещества А уменьшится на 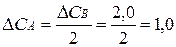 моль/л. Тогда концентрация вещества А станет равной
моль/л. Тогда концентрация вещества А станет равной 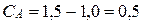 моль/л. Скорость реакции в этот момент будет равна:
моль/л. Скорость реакции в этот момент будет равна:
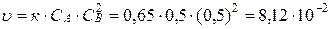
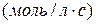 .
.
4.2.3. Температура
Скорость химической реакции зависит от температуры. По эмпирическому правилу Вант-Гоффа:
при повышении температуры на 10о скорость большинства химических реакций возрастает в 2-4 раза.
Математически эта зависимость выражается соотношением:
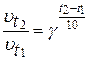 ,
,
где 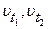 - скорости реакций при температурах t1 и t2;
- скорости реакций при температурах t1 и t2;
γ - температурный коэффициент скорости, равный 2 ¸ 4;
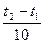 - число десятков градусов.
- число десятков градусов.
В соответствии с определением скорость реакции обратно пропорциональна времени реакции, следовательно:
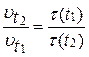 ,
,
где 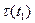 и
и 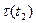 - время протекания реакции при температурах
- время протекания реакции при температурах 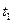 и
и 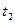 .
.
Пример 4. Реакция при температуре 500С протекает за 2мин 15с. За сколько времени закончится эта реакция при температуре 700С, если температурный коэффициент скорости реакции равен 3?
Решение.
В соответствии с правилом Вант-Гоффа определяем возрастание скорости:
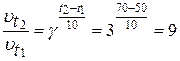 ,
,
т.е., скорость увеличится в 9 раз.
По определению скорость реакции обратно пропорциональна времени реакции, следовательно:
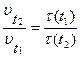 , где
, где 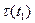 и
и 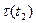 - время протекания реакции при температурах
- время протекания реакции при температурах 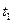 и
и 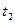 .
.
Отсюда:
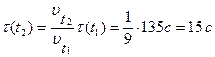 .
.
4.3. Химическое равновесие
Реакции, которые протекают в одном направлении до конца, называются необратимыми. Большинство реакций являются обратимыми, т.е. они протекают в противоположных направлениях и не идут до конца.
Например: H2 + J2 « 2 HJ.
В ходе реакции устанавливается подвижное равновесие, при котором скорости прямого (образования HJ) и обратного (распада HJ) процессов равны.
Химическое равновесие – это такое состояние системы реагирующих веществ, при котором скорости противоположных реакций равны, т.е. 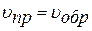 .
.
Для вышеприведенной реакции
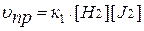 и
и 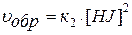 , где
, где
к1 – константа скорости прямой реакции,
к2– константа скорости обратной реакции,
[J2], [H2], [HJ] – равновесные концентрации веществ (моль/л).
При равновесии 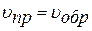 . Отсюда
. Отсюда
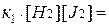
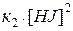
Разделяя переменные, получаем
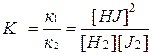 ,
,
где К – константа химического равновесия.
Константа равновесия К равна отношению констант скоростей прямой и обратной реакций, отношению произведения концентраций продуктов реакции к произведению концентраций исходных веществ в степени их стехиометрических коэффициентов. Она показывает во сколько раз скорость прямой реакции больше скорости обратной реакции, если концентрация каждого из реагирующих веществ равна 1 моль/л. В этом физический смысл К.
В общем виде для обратимой реакции
aA + bB « qQ + dD
константа равновесия выразится уравнением:
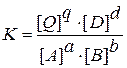
Константа равновесия зависит от температуры и природы реагирующих веществ, но не зависит от их концентраций. Действительно, если, например, увеличить [D], то должна уменьшиться [Q] и увеличиться [A] и [B], т.е. это приведет к смещению равновесия влево. Установится новое равновесие. Новые равновесные концентрации будут иметь другие числовые значения, однако отношение произведения их, возведенных в соответствующие степени, будет величиной постоянной. Отсюда, полученное соотношение есть уравнение закона действующих масс в общем виде.
Пример 5. В системе N2+3H2 « 2NH3
равновесие установилось при следующих концентрациях (моль/л): [Н2] = 1,8, [N2] = 2,5, [NH3] = 3,6. Рассчитайте константу равновесия этой реакции и исходные концентрации Н2 и N2.
Решение. Находим К:
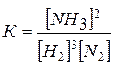 =
= 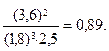
Из уравнения видно, что на образование 2 молей NH3 расходуется 1 моль N2, а на образование 3,6 молей NH3 потребуется 3,6/2 =1,8 моля N2. Учитывая равновесную концентрацию азота, находим его исходную концентрацию.
Сисх (N2) = 2,5 + 1,8 = 4,3 моль/дм3
Аналогично находим изменение концентрации Н2.
3,6 ×3/2 = 5,4 моля Н2
Сисх(Н2) =1,8 + 5,4 = 7,2 моль/дм3
Пример 6. В замкнутом сосуде установилось равновесие
2NO2«2NO +O2
Равновесная концентрация [NO] равна 0,24 моль/л. Определите исходную концентрацию NO2, если константа равновесия равна К= 2,05.
Решение.
Из уравнения реакции видно, что равновесная концентрация [О2] будет в 2 раза меньше концентрации [NO2], т.е. 0,24/2=0,12 моль/л.
Зная К находим равновесную концентрацию [NO2].
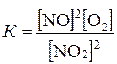 , отсюда
, отсюда
[NO2] = 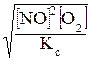 =
= 
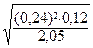 =0,058 (моль/л).
=0,058 (моль/л).
Так как из 2 молей NO2 получается 2 моль NO, следовательно, изменение концентрации NO2 будет равно 0,24 моль/л. Отсюда, зная равновесную концентрацию NO2 и его изменение, находим исходную концентрацию NO2.
С исх NO2 = 0,058 + 0,24 = 0,298 (моль/л).
4.3.1 Принцип Ле-Шателье
Смещение равновесия в зависимости от изменения концентрации реагирующих веществ, температуры, давления (в случае газообразных веществ) в общем виде определяется принципом Ле-Шателье:
Если на систему, находящуюся в состоянии равновесия, производится какое-либо внешнее воздействие, то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет воздействие.
Поясним это на примере синтеза аммиака:
N2 + 3H2 « 2NH3; DH = - 46 кДж/моль.
а) Влияние концентрации.
При увеличении концентрации азота или водорода усиливается реакция, вызывающая уменьшение концентрации этих веществ, и, следовательно, равновесие сместится вправо в сторону прямой реакции. Соответственно, увеличение концентрации аммиака смещает равновесие влево, в сторону обратной реакции. Это легко выводится из константы равновесия данной реакции:
К = 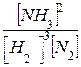
б) Влияние температуры
Поскольку прямая реакция протекает с выделением теплоты (реакция экзотермическая), повышение температуры благоприятствует протеканию реакции с поглощением тепла и равновесие сместится влево, в сторону обратной реакции, т.к. обратная реакция является эндотермической. Понижение температуры вызовет смещение равновесия вправо, в сторону прямой реакции.
в) Влияние давления
Чтобы определить влияние давления на смещение равновесия, необходимо подсчитать число молекул в левой и правой частях уравнения. В рассмотренном примере в левой части уравнения содержится четыре молекулы, а в правой две молекулы. Поскольку увеличение давления должно благоприятствовать процессу, ведущему к уменьшению числа молекул, то в данном случае равновесие сместится вправо, в сторону прямой реакции. Очевидно, уменьшение давления сместит равновесие влево. Если же в уравнении обратимой реакции число молекул в левой части равно числу молекул в правой части, например:
N2 + O2 « 2NO, то
изменение давления не вызывает смещения химического равновесия.
Следует заметить, что все катализаторы одинаково ускоряют как прямую, так и обратную реакции и поэтому на смещение равновесия влияния не оказывают, а только способствуют более быстрому его достижению.
Пример 7. Реакция протекает по уравнению:
4HCl + O2 « 2H2O + 2Cl2
В каком направлении сместится равновесие, если концентрацию всех веществ увеличить в 2 раза?
Решение. По ЗДМ скорости реакции равны:
uпр = к1 [HCl]4[O2]
uобр = к2 [H2O]2[Cl2]2
После увеличения концентраций:
uпр = к1 (2 [HCl]4 )(2[O2])=32 к1 [HCl]4[O2]
uобр = к2 ( 2[H2O]2 )(2[Cl2]2 ) =16 к2 [H2O]2[Cl2]2
Скорость прямой реакции возросла в 32 раза, а обратной в 16 раз. Следовательно, равновесие сместится в сторону прямой реакции.
Задачи к разделу 4:
«Кинетика химических реакций.
Химическое равновесие»
81 Исходные концентрации SO2 и О2 в системе
2SO2(г) + O2(г) « 2SO3(г)
были соответственно равны 0,5 и 0,8 моль/л. К моменту наступления равновесия концентрация оксида серы(VI) стала равной 0,3 моль/л. Вычислите равновесные концентрации остальных веществ системы и константу равновесия.
82 При некоторой температуре константа равновесия термической диссоциации
N2O4(г) « 2NO2(г)
равна 0,42. Равновесная концентрация NO2 0,32моль/л. Вычислите равновесную и начальную концентрации N2O4. Сколько этого вещества (в процентах) продиссоциировало к моменту равновесия?
83 При синтезе фосгена имеет место равновесие системы
Cl2(г) + CO(г) « COCl2(г)
Равновесные концентрации равны (моль/л): Cl2-0,5; СО-0,8; СОCl2-0,32.
Определите константу равновесия и исходные концентрации Cl2 и СО.
84 Исходные концентрации SO2 и О2 в системе
2SO2(г) + O2(г) « 2SO3(г)
были соответственно равны 0,8 и 0,6 моль/л. К моменту наступления равновесия концентрация оксида серы(VI) стала равной 0,4 моль/л. Вычислите равновесные концентрации остальных веществ системы и константу равновесия.
85 Реакция протекает по уравнению
2NO(г) + O2(г) « 2NO2(г)
Начальные концентрации NO и O2 соответственно равны 0,6 и 0,4 моль/л. Как изменится скорость реакции, если концентрацию NO увеличить до 0,8 моль/л, а концентацию кислорода до 1,2 моль/л.
86 Реакция идет по уравнению:
2А + В ® С.
Константа скорости этой реакции равна 0,5 (л)2×моль-2×с-1, а начальные концентрации веществ составляли (моль/л): А-0,4 и В-0,6. Вычислите скорость реакции в начальный момент времени и после того, как прореагирует 0,2 моль/л вещества А.
87 Разложение N2O протекает по уравнению:
2N2O(г) = 2N2(г) + O2(г)
Константа скорости при 1173К равна 5×10-4(л)2×моль-2×с-1. Начальная концентрация N2O равна 3,2моль/л. Определите скорость реакции при заданной температуре в начальный момент и в тот момент, когда разложится 25 % N2O.
88 При повышении температуры на 20оС скорость реакции синтеза аммиака возросла в 9 раз. Определите температурный коэффициент скорости этой реакции.
89 Вычислите, при какой температуре реакция закончится за 30 мин, если при 293 К на это требуется 2 часа. Температурный коэффициент скорости реакции равен 3.
90 При 393 К реакция заканчивается за 18 минут. За какое время закончится эта реакция при 443 К, если температурный коэффициент скорости реакции равен 3,5.
91 Равновесные концентрации веществ в системе
Н2(г) + J2(г) « 2HJ(г)
равны (моль/л): Н2 – 0,25, J2 – 0,05, HJ –0,9.
Определите константу равновесия и исходные концентрации J2 и Н2.
92 Концентрации веществ в равновесной системе
N2O4(г) « 2NO2(г)
равны (моль/л): N2O4 – 0,0055, NO2 – 0,0189. Вычислите константу равно-
весия и исходную концентрацию N2O4.
93 Константа равновесия реакции
N2(г) +3H2(г) « 2NH3(г)
при 673 К равна 0,1. Равновесные концентрации (моль/л): Н2–0,6, NH3– 0,18. Вычислите начальную и равновесную концентрации N2.
94 При некоторой температуре константа равновесия термической диссоциации
N2O4(г) « 2NO2(г)
равна 0,26. Равновесная концентрация NO2 0,28 моль/л. Вычислите равновесную и начальную концентрации N2O4. Сколько этого вещества (в процентах) продиссоциировало к моменту равновесия?
95 При синтезе фосгена имеет место равновесие системы
Cl2(г) + CO(г) « COCl2(г)
Равновесные концентрации равны (моль/л): Cl2-2,5; СО-1,8; СОCl2-3,2.
Определите константу равновесия и исходные концентрации Cl2 и СО.
96 Равновесие реакции
2NO(г) + O2(г) « 2NO2(г)
установилось при следующих концентрациях реагирующих веществ (моль/л): [NO]-0,5; [О2] -0,7;[NO2] -2,1.
Определите константу равновесия. Как изменятся скорости прямой и обратной реакций, если в системе давление уменьшится в 2 раза? Куда сместится равновесие системы?
97 Исходные концентрации SO2 и О2 в системе
2SO2(г) + O2(г) « 2SO3(г)
были соответственно равны 0,3 и 0,45 моль/л. К моменту наступления равновесия концентрация оксида серы(VI) стала равной 0,2 моль/л. Вычислите равновесные концентрации остальных веществ системы и константу равновесия.
98 Определите равновесную концентрацию водорода в реакции:
2HJ(г) « Н2(г) + J2(г),
если исходная концентрация HJ составляет 0,55 моль/л, а константа
равновесия К =0,12.
99 Константа равновесия реакции
FeO(г) + СО(г) « Fe(г) + СО2(г)
при некоторой температуре равна 0,5. Определите равновесные концентра-
ции СО и СО2, если начальные концентрации этих веществ составляли 0,05 моль/л и 0,01 моль/л.
100 Начальные концентрации веществ в реакции:
СО(г) + H2O(г) « CO2(г) +H2(г)
были равны (моль/л): СО – 0,5; H2О – 0,6; СО2 – 0,4; Н2 – 0,2. Вычислите концентрации всех участвующих в этой реакции веществ после того, как прореагировало 60% воды.
аздел 5
