Кинетика химических реакций
Цель работы: изучить влияние различных факторов (концентрации, температуры, присутствия катализатора, степени измельчения на скорость реакции).
ТЕОРЕТИЧЕСКОЕ ОБОСНОВАНИЕ
Химическая кинетика изучает скорость и механизм химических процессов. Скорость химической реакции равна числу актов взаимодействия в единицу времени в единице объема для гомогенных реакций, или на единицу поверхности раздела фаз для гетерогенных реакций.
Гомогенные реакции протекают в одной фазе, например, в газовой
H2 (г) + Cl2 (г) ® 2HCl (г)
Гетерогенные – на границе раздела фаз, например, горение угля происходит на поверхности твердой фазы
C (т) + О2 (г) ® СО2 (г)
Скорость гомогенной реакции количественно характеризуется изменением концентрации (обычно молярной) любого участника реакции в единицу времени (как правило, выражаемого в секундах).
Средняя скорость реакции Vср в интервале времени от t1 до t2 определяется соотношением

 Vср =
Vср = 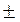
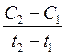 =
= 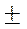
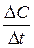 ,
,
С1 и С2 – молярная концентрация любого участника реакции в моменты времени t1 и t2 соответственно. Знак « − » перед дробью относится к концентрации исходных веществ, 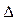 С < 0, знак « + » - к концентрации продуктов реакции
С < 0, знак « + » - к концентрации продуктов реакции 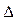 С > 0. Скорость реакции всегда величина положительная, единица измерения моль/л.
С > 0. Скорость реакции всегда величина положительная, единица измерения моль/л.
Мгновенная скорость – это скорость реакции в данный момент времени t. Она определяется производной от концентрации по
времени:
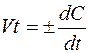
Скорость реакции зависит от природы и концентрации реагирующих веществ, температуры, давления (если в реакции участвуют газы), катализатора, площади поверхности раздела фаз (гетерогенные реакции), от облученя квантами света и др. факторов.
Количественную характеристику скорости процесса от концентрации устанавливает закон действующих масс:
скорость химической реакции при данной температуре прямопропорциональна произведению концентраций реагирующих веществ в степенях с показателями, равными стехиометрическим коэффициентам в уравнении реакции.
Закон открыт К.М. Гульдбергом и П Вааге в 1864 – 1867 гг.
Для реакции в общем виде aA + bB ® dD + mM ее скорость, согласно закону действующих масс, выражается соотношением

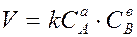
Где 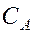 и
и 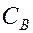 – молярные концентрации реагирующих веществ А и В; k – константа скорости данной реакции, равная
– молярные концентрации реагирующих веществ А и В; k – константа скорости данной реакции, равная 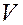 , если
, если 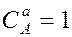 и
и 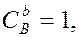 и зависящая от природы реагирующих веществ, температуры, катализатора, площади поверхности раздела фаз (для гетерогенных реакций). Выражение зависимости скорости реакции от концентрации называют кинетическим уравнением.
и зависящая от природы реагирующих веществ, температуры, катализатора, площади поверхности раздела фаз (для гетерогенных реакций). Выражение зависимости скорости реакции от концентрации называют кинетическим уравнением.
Для гомогенной реакции
2NO (г) + H2 (г) ® N2O (г) + H2O (пар) оно имеет вид
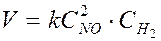 .
.
Для гетерогенных реакций в кинетическое уравнение входят только концентрации газообразных и растворенных веществ. Так, для реакции горения серы S (т) + O2 (г) ® SO2 (г) соударения между молекулами кислорода и твердого вещества могут происходить только на поверхности раздела фаз, поэтому общая масса твердой фазы не влияет на скорость реакции, 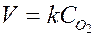 , то есть скорость пропорциональна концентрации кислорода.
, то есть скорость пропорциональна концентрации кислорода.
Зависимость скорости реакции от температуры приближенно определяется эмпирическим правилом Вант-Гоффа:
 при повышении температуры на каждые 10 градусов скорость большинства реакций увеличивается в 2-4 раза
при повышении температуры на каждые 10 градусов скорость большинства реакций увеличивается в 2-4 раза
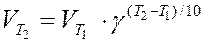 ,
,
где 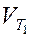 и
и 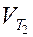 - скорость реакции соответственно при температурах Т1 и Т2 (Т2 > Т1); g - температурный коэффициент скорости реакции
- скорость реакции соответственно при температурах Т1 и Т2 (Т2 > Т1); g - температурный коэффициент скорости реакции
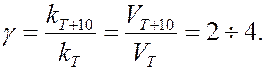
Более точно зависимость скорости от температуры выражается уравнением Аррениуса (1889 г.).
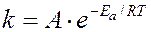 ,
,
где 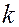 - константа скорости; А – предэкспоненциальный множитель, не зависящий от температуры и концентрации;
- константа скорости; А – предэкспоненциальный множитель, не зависящий от температуры и концентрации; 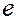 - основание натурального логарифма; R – универсальная газовая постоянная; Т – температура, К; Еа – постоянная, называемая энергией активации. Энергия активации является характеристикой каждой реакции и определяет влияние на скорость реакции природы реагирующих веществ.
- основание натурального логарифма; R – универсальная газовая постоянная; Т – температура, К; Еа – постоянная, называемая энергией активации. Энергия активации является характеристикой каждой реакции и определяет влияние на скорость реакции природы реагирующих веществ.
В соответствии с уравнением Аррениуса скорость реакции уменьшается с ростом энергии активации. Из уравнения Аррениуса так же следует, что чем выше энергия активации, тем выше градиент скорости реакции по температуре. Теория переходного состояния дает понятие об энергии активации и отвечает на вопрос, почему Еа влияет на скорость реакции. В ходе реакции система проходит через образование активированного комплекса. Например, путь реакции АВ + ДС = АД + ВС  можно представить схемой
можно представить схемой
А – В А . . .В А В
+ ® :  : ® ½ + ½
: ® ½ + ½
Д – С Д . . .С Д С
Исходные Активированный Продукты
молекулы комплекс реакции
В активированном комплексе старые связи не разорваны, но уже ослаблены, новые связи наметились, но еще не образовались. Это не промежуточное химическое соединение, а лишь переходное состояние реагирующих частиц в момент столкновения. Время его существования ничтожно ( 10 -14 – 10 – 11с.), оно короче времени соударения. Конфигурация активированного комплекса соответствует максимуму потенциальной энергии (система неустойчива), поэтому он самопроизвольно распадается с образованием либо продуктов реакции, либо исходных веществ.
Энергия, необходимая для перехода реагирующих веществ в состояние активированного комплекса, называется энергией активации (Еа). Молекулы, энергия которых достаточна для образования активированного комплекса, называются активными. С повышением температуры резко (в геометрической прогрессии) растет число молекул, энергия которых равна или выше энергии активации, соответственно растет доля молекул, способных к активным столкновениям с образованием активированного комплекса, т.е. происходит ускорение реакции.
Экзотермические реакции протекают с меньшей энергией активации, чем эндотермические. Большая энергия активации Еа (высокий энергетический барьер) является причиной того, что многие химические реакции при невысоких температурах не протекают, хотя принципиально возможны (DG < 0). Так, в обычных условиях самопроизвольно не загораются: дерево, ткани, бумага, уголь, хлеб, керосин, хотя энергия Гиббса реакций окисления этих веществ ниже нуля (DG < 0). При высоких температурах доля активных частиц велика и реакции идут быстро. Например, при температурах 10000 К и выше реакции завершаются за 10 -5 – 10 –3 с.
Скорость химической реакции можно изменить с помощью катализатора. Катализаторы это вещества, которые, увеличивают скорость реакции, но не расходуются в результате ее протекания. Механизм ускоряющего действия катализаторов в том, что они уменьшают энергию активации химического процесса.
Оборудование и реактивы: штатив с пробирками, пипетки, термометры на 50 0С – 3 шт., 1 н раствор тиосульфата натрия, 0,5 н раствор серной кислоты, 10% - ный раствор перекиси водорода, порошок диоксида марганца.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
