П 8. Кинетика химических реакций.
Определение порядка химической реакции по реагентам, общего порядка реакции по таблицам экспериментальных данных. Расчет изменения текущих концентраций реагентов по времени для химических реакций. Расчет периода полупревращения (полураспада).
Расчет скорости химических реакций. Расчет влияния температуры на скорость химической реакции.
Пример 1. При исследовании кинетики химической реакции
aA + bB → D
получили результаты зависимости времени протекания химической реакции от концентрации реагентов:
| время, сек | ||||
| сА, моль/л | 0,003 | 0,012 | 0,012 | 0,024 |
| сВ, моль/л | 0,001 | 0,006 | 0,012 | 0,001 |
По результатам эксперимента определите порядок реакции и напишите основное кинетическое уравнение химической реакции.
Решение. Запишем основное кинетическое уравнение химической реакции в общем виде:
v=k.cAα.cB β,
где k – константа скорости реакции; cА, cВ – текущие концентрации веществ; α, β – коэффициенты, называемые порядками реакции по веществам А и В, определяются экспериментально.
Общий порядок реакции n= α + β .
Изучив таблицу экспериментальных данных, делаем вывод, что при увеличении концентрации вещества А в 8 раз при постоянной концентрации вещества В (колонки 1,4), время протекания реакции уменьшилось в 8 раз, следовательно, скорость реакции увеличилась в 8 раз. При увеличении концентрации вещества В в 2 раза при постоянной концентрации вещества А (колонки 2,3), время протекания реакции уменьшилось в 2 раза, следовательно, скорость реакции увеличилась в 2 раза.
v=k.cAα., v=k.cB β,
Делаем вывод, что порядок реакции по веществу А α = 1, порядок реакции по веществу В β = 1. Общий порядок реакции n= α + β =2.
Кинетическое уравнение химической реакции:
v=k.cA.cВ.
Пример 2.Для реакции первого порядка А → D определите время, за которое прореагирует 90 % вещества А. Константа скорости реакции k=10-4 с-1.
Решение. После превращения 90% вещества А его концентрация составит 10% от начальной концентрации, т.е. с = 0,1с0.
Для реакции первого порядка справедливо уравнение
c=с0 . е -kτ
гдес0 – исходная концентрация вещества А, моль/л.
с - концентрация в момент времени t .
Подставив исходные данные в это уравнение, получим: 0,1с0 = c0-kτ,
откуда τ= ln10/k = ln10/10-4 = 23026 с = 6,4 час.
Пример 3. При некоторой температуре константа скорости химической реакции второго порядка
2A → D
k = 8,83.10-16 л/моль.с. Определите время полупревращения τ1/2 вещества А, если его начальная концентрация с0 =1 моль/л.
Решение.Время полупревращения τ1/2 – время, за которое прореагирует половина исходного количества вещества, т.е. с = с0/2.
Для реакции второго порядка справедливо уравнение
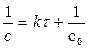
гдес0 – исходная концентрация вещества А, моль/л.
с - концентрация в момент времени t .
Тогда, с учетом с = с0/2, получаем
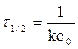 ,
,
считаем: 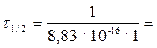 1,13.1015 с = 3,6.107 лет.
1,13.1015 с = 3,6.107 лет.
Пример 4.Рассчитайте изменение скорости реакции, имеющей энергию активации Еа = 191 кДж/моль, при увеличении температуры от330 до 400 К.
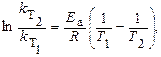 |
Решение. Зависимость константы скорости реакции от температуры определяется уравнением Аррениуса:
где k T1 и kT2 – константы скорости химической реакции при температурах Т1 и Т2, соответственно.
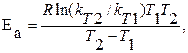 |
Если известны константы скорости химической реакции при двух температурах, то можно рассчитать энергию активации химической реакции:
где R =8,31 Дж/моль.К – универсальная газовая постоянная.
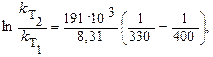 |
Подставим исходные данные задачи в уравнение Аррениуса:
произведем математические вычисления и получим:
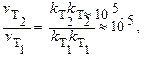 |
т.к. скорость химической реакции прямопропорциональна константе скорости, то,
т.е.скорость данной реакции при нагревании увеличится в 105 раз.
