Действие группового реагента.
К 3 каплям раствора соли Ni2+ прибавить 1-2 капли 2М раствора NH4OH. Образуется основная соль
2NiSO4 + 2NH4OH ® ¯(NiOH)2SO4 + (NH4)2SO4
светло-зеленый
К полученному осадку при перемешивании добавить 3-4 капли при перемешивании концентрированного раствора NH4OH. Происходит растворение осадка и образование комплексного соединения:
¯(NiOH)2SO4 + 12 NH4OH ® 2[Ni(NH4)6](OH)2 + (NH4)2SO4 + 12Н2О
синий
Едкие щелочи NaOH и KOHосаждают ионы никеля в виде Ni(OH)2 светло-зеленого цвета:
Ni2+ + 2OH-  Ni(OH)2¯
Ni(OH)2¯
Выполнение реакции: К 1-2 каплям раствора соли никеля прибавить 1-2 капли 2М раствора NaOH. Полученный осадок разделить на 2 части. К одной части прибавить 3-4 капли 2М раствора NaOH. Осадок не растворяется. К другой части раствора прибавить 3-4 капели 2М раствора HCl. Осадок растворяется с образованием растворимой соли никеля:
Ni(OH)2 + 2HCl  NiCl2 + H2O
NiCl2 + H2O
Диметилглиоксим (Реактив Чугаева)осаждает катионы Ni2+ в аммиачной среде в виде внутрикомплексного соединения ало-красного цвета:

 СН3 - С = NOH HON = C – CH3
СН3 - С = NOH HON = C – CH3
+ Ni2+ + + 2NH3 ®
CH3 - C = NOH HON = C – CH3
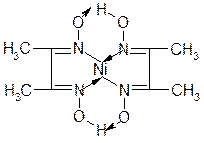
Выполнение реакции:
К 2-3 каплям раствора соли никеля добавить по 2-3 капли NH4OH и 2-3 капли реактива Чугаева. Полученный осадок разделить на 2 части и проверить на растворимость в HCl и концентрированном растворе NH4OH.
Условия реакции:
1. Аммиачная среда, рН = 8.
2. Реакции мешают ионы Fe2+ , Cu2+. Для удаления мешающего влияния данных катионов, их удаляют, связывая в нерастворимые фосфаты. Для этого на фильтровальную бумагу наносят каплю раствора Na2HPO4 , каплю соли никеля, а затем еще каплю Na2HPO4. На влажное пятно нанести каплю реактива Чугаева и подержать бумагу над открытым сосудом с концентрированным раствором NH4OH.
Реакции иона Со2+.
Раствор NH4ОН, добавленный в эквивалентном количестве осаждает катион Со2+ в виде основной соли CoOHCl синего цвета.
Выполенение реакции:
К 3 каплям раствора соли Со2+ прибавить 1-2 капли 2М раствора NH4ОН.
CoCl2 + NH4OH ® ¯CoOHCl + NH4Cl
синий
Полученный осадок разделить на 2 части:
К первой части прибавить 3-4 капли 3%-ного раствора Н2О2, а затем в обе части осадка добавить 3-4 капли насыщенного раствора NH4OH и 3-4 капли насыщенного раствора NH4Cl.
В первой пробирке происходит реакция образования комплексного соединения гесаамминкобальта (Ш) вишнево-красного цвета:
2CoCl2 + 10NH4OH + 2NH4Cl + H2O2 ® 2[Co(NH3)6]Cl3 + 12H2O
Во второй пробирке происходит образование комплексного соединения гесаамминкобальта (П) желто-бурого цвета:
CoOHCl + 5NH4OH + NH4Cl ® [Co(NH3)6]Cl2 + 6H2O
Едкие щелочи NaOH и KOHосаждают катионы Со2+ в виде основной соли синего цвета:
CoCl2 + NаOH ® ¯CoOHCl + NаCl
синий
Выполнение реакции:
К 2-3 каплям раствора соли Со2+ прибавить 1-2капли 2М раствора NaOH. Осадок разделите на 2 части. К одной части прибавить 1-2 капли 2M раствора NaOH и нагреть на водяной бане.
СоОНCl + NaOH ® Co(OH)2 + NaCl
Образуется гидроксид кобальта Со(ОН)2 розового цвета.
Осадок разделите на 2 части и убедитесь, что он растворяется в кислотах и щелочах при нагревании.
В пробирку поместите 2-3 капли раствора соли Со2+ , добавьте 1-2 капли 2М раствора NaOH и 1-2 капли 3% раствора Н2О2. Образуется осадок Со(ОН)3 бурого цвета
2CoCl2 + 4NaOH + H2O2 ® ¯2Co(OH)3 + 4NaCl
Убедитесь, что в отличие от Co(OH)2 осадок Co(OH)3 не растворяется в кислотах.
Тиоцианат аммония NH4NCSв присутствии амилового спирта образует с ионом Со2+ комплексную соль состава (NH4)2[Co(NCS)4] синего цвета:
СоСl2 + 4NH4NCS  (NH4)2[Co(NCS)4] + 2NH4Cl
(NH4)2[Co(NCS)4] + 2NH4Cl
Выполнение реакции:
К 2-3 каплям раствора соли Со2+ добавьте 8 капель насыщенного раствора NH4NCS и 5-6 капель амилового спирта, перемешайте. При этом верхний органический слой окрасится в синий цвет в результате экстракции амиловым спиртом комплексного соединения (NH4)2[Co(NCS)4]
Условия реакции:
1. Реакцию следует проводить при рН = 4-5.
2. Так как комплексоное соединение (NH4)2[Co(NCS)4] очень непрочное, то для сдвига равновесия вправо, берется избыток NH4NCS.
3. Необходимо брать амиловый спирт, так как в органическом растворителе повышается устойчивость комплексного соединения.
4. Реакции мешают катионы Fe3+, поэтому их маскируют добавленеим винной кислоты или NaF, которые образуют с Fe3+ бесцветные комплексные соединения.
