Опыт 2. Изучение окислительных свойств перманганата калия.
Ход работы.Проделайте следующие реакции по схеме, используя для этого сульфит натрия, растворы щелочи и серной кислоты:
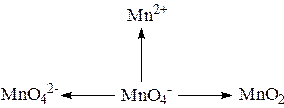
Напишите уравнения реакций. Сделайте вывод.
Опыт 3. Качественные реакции на ионы Fe2+ и Fe3+
Ход работы
а) К раствору соли Fe2+ прилейте раствор красной кровяной соли. Что происходит? Напишите уравнения реакций.
б) В две пробирки налейте 1М раствора соли FeCl3. В одну прибавьте несколько капель раствора роданида калия, в другую − раствора K4[Fe(CN)6]. Что происходит? Напишите уравнения реакций.
Сделайте вывод.
Контроль усвоения темы занятия
Типовой тест выходного контроля
Выберите один правильный ответ
1. В составе гемоглобина железо находится в степени окисления
1) +2; 2) +3; 3) 0; 4) +6.
2. Элементы Fe, Co, Ni - это
1) микроэлементы, кофакторы ферментов;
2) микроэлементы, «металлы жизни»;
3) ультрамикроэлементы, выполняют регуляторную функцию;
4) органогенные элементы.
3. Процесс MnO4- → MnO2 проводили в среде
1) кислой; 2) нейтральной; 3) щелочной.
Типовые задачи
1. Из предложенного списка выберите соединения, которые проявляют только восстановительные свойства, только окислительные, амфотерные свойства: СrCl2, СrСl3, Сr(ОН)3, Сr2O3, CrO5, К2Cr2O7.
2. Напишите уравнения реакций, в которых из сульфата марганца (II) получаются: а) гидроксид марганца (III) б) диоксид марганца и марганцовая кислота.
3. Рассчитайте массу KMnO4, необходимую для приготовления 5 литров 0,02 н раствора. (Ответ: 3,16 г).
4. Осуществите превращения:
Fe2O3→Fe→FeCl2→ Fe(OH)2→Fe(OH)3 → Fe2(SO4)3 → KFe[Fe(CN)6];
Подведение итогов занятия
7.6. Задание на дом. Подготовка к контрольной работе по модулю «Металлы и их соединения».
Место проведения самоподготовки: читальный зал и др.
Литература:Основная: [1] стр. 230-254; 263-299; 309-328.
Дополнительная: [3] стр. 57-150; 298-520;
[3] стр. 135-213.
Занятие 12
Тема. Контрольная работа по модулю «Металлы и их соединения»
Учебные цели:обобщить материал занятий 8-11, проверить его усвоение.
Материалы для самоподготовки к усвоению данной темы
Вопросы для самоподготовки к занятию
1. Общая характеристика щелочных металлов: положение в периодической системе, строение электронной оболочки, валентность, нахождение в природе.
2. Простые вещества – щелочные металлы. Физические и химические свойства.
3. Характеристика оксидов, пероксидов и гидроксидов щелочных металлов на примере натрия.
4. Характеристика солей щелочных металлов: карбонатов, фосфатов, сульфатов, галогенидов на примере натрия.
5. Биологическая роль металлов IA группы.
6. Общая характеристика элементов IIA группы: положение в периодической системе, строение электронной оболочки, валентность, нахождение в природе.
7. Простые вещества – бериллий, магний, щелочноземельные металлы, радий. Физические и химические свойства. Качественные реакции на ионы Ca2+, Mg2+, Sr2+, Ba2+.
8. Характеристика оксидов и гидроксидов элементов IIA группы.
9. Характеристика солей щелочноземельных металлов: карбонатов, сульфатов, галогенидов на примере кальция.
10. Биологическая роль элементов IIA группы.
11. Общая характеристика металлов IIIA группы: положение в периодической системе, строение электронной оболочки, валентность, изменение химической активности, нахождение в природе.
12. Простое вещество – алюминий. Физические и химические свойства. Амфотерность.
13. Характеристика оксидов и гидроксидов металлов IIIA группы.
14. Характеристика солей металлов IIIA группы: сульфатов, ацетатов, галогенидов на примере алюминия.
15. Биологическая роль металлов IIIA группы .
16. Общая характеристика металлов IVA группы: положение в периодической системе, строение электронной оболочки, валентность, изменение химической активности, нахождение в природе.
17. Простые вещества – олово, свинец. Физические и химические свойства.
18. Характеристика оксидов, гидроксидов и солей металлов IVA группы.
19. Биологическая роль металлов IVA группы.
20. Общая характеристика металлов IБ группы: положение в периодической системе, строение электронной оболочки, проявляемые степени окисления, изменение химической активности, нахождение в природе.
21. Простые вещества – медь, серебро, золото. Физические и химические свойства.
22. Характеристика соединений серебра: оксида, нитрата, комплексов.
23. Характеристика соединений меди (II): оксида, гидроксида, сульфата, комплексов. Качественные реакции на ионы Сu2+.
24. Биологическая роль металлов IБ группы .
25. Общая характеристика металлов IIБ группы: положение в периодической системе, строение электронной оболочки, проявляемые степени окисления, изменение химической активности, нахождение в природе.
26. Простые вещества – цинк, кадмий, ртуть. Физические и химические свойства.
27. Токсичность кадмия и ртути.
28. Характеристика оксида и гидроксида цинка. Комплексные соединения цинка.
29. Роль меди и цинка в функционировании живых организмов.
30. Общая характеристика металлов VIБ группы: положение в периодической системе, строение электронной оболочки, проявляемые степени окисления, изменение химической активности, нахождение в природе.
31. Общая характеристика металлов VIIБ группы: положение в периодической системе, строение электронной оболочки, проявляемые степени окисления, изменение химической активности, нахождение в природе.
32. Общая характеристика металлов VIIIБ группы: положение в периодической системе, строение электронной оболочки, проявляемые степени окисления, изменение химической активности, нахождение в природе.
33. Физические и химические свойства простых веществ: хрома, железа, марганца.
34. Cоединения хрома (III): оксид, гидрокисид, гидроксокомплексы и их особенности.
35. Соединения хрома (IV): хромовые кислоты и их соли. Окислительные свойства.
36. Кислотно-основные свойства гидроксидов марганца (II) и (IV).
37. Кислотно-основные свойства гидроксидов марганца (VI) и (VII).
38. Окислительные свойства перманганат-иона в зависимоти от кислотности среды.
39. Свойства соединений железа (II): оксида, гидроксида. Качественные реакции на ионы Fe2+.
40. Свойства соединений железа (III): оксида, гидрокисида и их особенности. Качественные реакции на ионы Fe3+.
41. Биологическая роль металлов VIБ-VIIIБ групп.
Вид занятия:контрольная работа.
Продолжительность занятия:2 академических часа.
Оснащение рабочего места:справочник физико-химических величин, периодическая таблица химических элементов Д.И.Менделеева, таблица растворимости, калькуляторы.
Содержание занятия
Образец билета
1. Общая характеристика щелочных металлов: положение в периодической системе, строение электронной оболочки, валентность, нахождение в природе.
2. Свойства соединений железа (III): оксида, гидрокисида и их особенности. Качественные реакции на ионы Fe3+.
3. Осуществите превращение:
Ag → Ag2S → AgNO3 → AgCl → [Ag(NH3)2]Cl → AgNO3 → Ag.
4. Какой объем воды необходимо взять, чтобы из 45 г сульфата алюминия приготовить 20 %-ный раствор?
Задание на дом.Подготовка к аттестации по практическим навыкам и итоговому тестированию.
Место проведения самоподготовки: читальный зал и др.
Литература:Основная: [1] стр. 223-254; 318-391.
Дополнительная: [2] стр. 25-150; 298-520;
[3] стр. 135-361; 462-617.
Занятие 13
