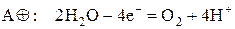Методы защиты металлов от коррозии
Основным способом защиты от коррозии является нанесение защитного покрытия. Защитные покрытия бывают неметаллические и металлические. Неметаллические покрытия – это лаки, краски, эмали, оксидные или фосфатные пленки.
Металлические покрытия различают анодные и катодные. Если поверхность защищаемого металла покрыта другим металлом с большей реакционной способностью, то такое покрытие называется анодным. В случае нарушения анодного покрытия разрушается металл покрытия. Если поверхность защищаемого металла покрыта менее активным металлом, то такое покрытие называется катодным. В случае нарушения катодного покрытия разрушается металл
ЭЛЕКТРОЛИЗ
Электролизом называются окислительно-восстановительные реакции, протекающие на электродах при пропускании постоянного электрического тока от внешнего источника через раствор или расплав электролита.
При электролизе работа электрического тока превращается в свободную энергию (энергию Гиббса) продуктов электролиза (т. е. электрическая энергия превращается в химическую). Электролиз используется для получения энергоемких химических веществ, таких как H2, Cl2, металлы (Al, Zn, Ni, Cu, щелочные металлы), а также многих окислителей (KMnO4, H2S2O8, H2O2, MnO2).
Суммарная окислительно-восстановительная реакция, протекающая при электролизе, самопроизвольно идти не может, т. е. энергия Гиббса такой реакции больше нуля. Самопроизвольно может проходить обратная реакция, которая может быть основой работы гальванического элемента. Поэтому любому процессу электролиза соответствует гальванический элемент, в котором протекает окислительно-восстановительная реакция, обратная к той, которая идет при электролизе. При электролизе на электродах протекают полуреакции, обратные к тем, которые проходят в соответствующем гальваническом элементе.
Катодом в электролитической ячейке так же, как и в гальваническом элементе, будет электрод, на котором протекает полуреакция восстановления, а анодом – электрод, на котором протекает полуреакция окисления. Однако знаки электрических потенциалов электродов поменяются в сравнении с гальваническим элементом: катод будет иметь отрицательный потенциал, т. е. «–», а анод – положительный, т. е. «+».
Электроды, используемые в электролитической ячейке, могут быть нерастворимыми или растворимыми. Нерастворимые электроды не участвуют в электродных процессах, и к ним относят благородные металлы, графит, оксидные электроды. Растворимыми в процессе электролиза могут быть электроды из активных металлов, используемые в качестве анодов.
Ионы, образующиеся при диссоциации электролита, перемещаются к катоду (катионы) и аноду (анионы), где и происходят окислительно-восстановительные процессы.
При электролизе расплавов солей на катоде будет идти восстановление катионов металла:
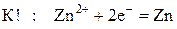
а на аноде – окисление анионов кислотного остатка. На аноде легко окисляются простые бескислородные анионы: Cl–, Br–, I–, S2–, например
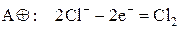
Окисление кислородсодержащих ионов протекает более сложно.
При электролизе водных растворов солей на катоде может идти восстановление катионов металла или/и молекул воды. Молекулы воды восстанавливаются на катоде до водорода:
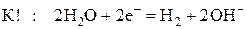
На аноде также может проходить окисление анионов кислотного остатка или/и молекул воды. Молекулы воды окисляются на аноде до кислорода: