Методы защиты металлов от коррозии
Все методы защиты условно делятся на следующие группы:
а)легирование металлов;
б) защитные покрытия;
в) электрохимическая защита;
г) изменение свойств коррозионной среды;
д) рациональное конструирование изделия.
При легировании в состав сплава вводят компоненты, вызывающие пассивность металла. Легирующими добавками в сталь являются Cr, Ni, W и другие.
Защитные покрытия исключают контакт металла с атмосферой и электролитом. Покрытия могут быть органическими (лаки, краски, эмали, полимерные пленки), металлическими. Последние подразделяются на катодные и анодные. К катодным относятся покрытия, потенциал которых имеет более положительное значение, чем потенциал основного металла. Например, для стали катодными покрытиямимогут служить медь, никель, серебро.
При повреждении покрытия возникает гальванический элемент, в котором защищаемый металл служит анодом и окисляется, а материал покрытия – катодом, на котором выделяется водород или поглощается кислород.
Рассмотрим процессы, протекающие на электродах при нарушении катодного покрытия в случае «луженого» железа.
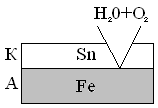
A Fe|H2O + O2| Sn K
e0 Fe/Fe2+ = -0.44B e0 Sn/Sn2+ = -0,14B
 2 A: Fe –2e = Fe2+
2 A: Fe –2e = Fe2+
1 K: 2H2O + O2 + 4e = 4OH-
 2Fe + 2H2O = O2 = 2Fe(OH)2
2Fe + 2H2O = O2 = 2Fe(OH)2
Электроны переходят от железа к олову, где связываются молекулами кислорода в присутствии молекул воды.
В случае анодных покрытий материал покрытия имеет более отрицательный потенциал, чем потенциал основного металла. Примером анодного покрытия для железа могут быть такие металлы, как цинк, алюминий, хром, титан. При нарушении анодного покрытия в случае «оцинкованного» железа защищаемый металл не разрушается, разрушается само покрытие.
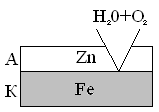
 A Zn | H2O + O2 | Fe K
A Zn | H2O + O2 | Fe K
2 A Zn – 2e = Zn2+
 1 K 2H2O + O2 + 4e = 4OH-
1 K 2H2O + O2 + 4e = 4OH-
2Zn + 2H2O + O2 = 2Zn(OH)2
Методы электрохимической защитыоснованы на создании гальванического элемента, в котором роль катода выполняет защищаемый металл (деталь, конструкция). Если к защищаемой конструкции присоединить кусок более активного металла (например, магния ), то в среде электролита конструкция будет выполнять роль катода, а магний (протектор) – функцию анода (протекторная защита).
Катодная защита исключает возможность разрушения конструкции за счет подключения ее к катоду (отрицательному полюсу) внешнего источника тока, а анодом служит металлоломом.
Для снижения агрессивности среды уменьшают концентрацию кислорода, ионов водорода.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
88. Как протекает коррозия цинка, находящегося в контакте с кадмием, в нейтральном и кислотном растворах. Составить электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии.
89. Серебро не вытесняет водород из разбавленных кислот. Почему? Если к серебру опущенному в кислоту прикоснуться цинковой палочкой то на нем начинается бурное выделение водорода. Объяснить это явление. Составить уравнения происходящей при этом реакции.
90. Какой из металлов является катодом, а какой анодом в паре Fe-Al. Составьте уравнение электродных процессов протекающих при коррозии в случае кислородной и водородной деполяризации.
91. Какое покрытие металлов называется анодным. Составьте электронные уравнения процессов, происходящих при коррозии железа, покрытого цинком во влажном воздухе. Что является продуктом реакции.
92. Какое покрытие является катодным. Назовите несколько металлов которые могут служить для катодного покрытия железа. Составьте электронные уравнения процессов, происходящих при коррозии железа, покрытого медью в серной кислоте. Что является продуктом реакции.
93. Как происходит коррозия луженного железа: а) во влажном воздухе; б) в кислоте. составить электронные уравнения реакций на аноде и катоде.
94. Магнитная пластинка, соединенная с оловянной опущена в хлороводородную кислоту. Составить электронные уравнения реакций на аноде и катоде протекающих при коррозии пластинки.
95. В чем заключается принцип применения прожекторной защиты от коррозии? Составить электронные уравнения реакций на аноде и катоде протекающих при прожекторной защите никеля в воде, содержащей растворенный кислород.
96. Изделие из технического железа находятся под дождем. Составить электронные уравнения реакций на аноде и катоде протекающих при коррозии, а также схему коррозийного микрогальванического элемента.
97. Два кусочка цинка одинаковой массы находятся в контакте с медью и свинцом в растворе хлороводородной кислоты. Какой из них растворится быстрее. Составить электронные уравнения процессов протекающих при коррозии и схемы образовавшихся коррозийных гальванических элементов.
98. Никелевую деталь покрыли свинцом. Какое это покрытие? Составить электронные уравнения процессов протекающих при коррозии этой детали во влажном воздухе при повреждении покрытия.
99. Составить электронные уравнения анодного и катодного процессов протекающих при протекторной защите стали в морской воде в помощью цинкового состава.
100. Сравните химическую стойкость железа в контакте с алюминием и оловом.
101. Алюминиевая деталь находится в постоянном контакте с медным токопроводом причем все устройство работает в условиях повышенной влажности в воздушной среде. Определить анод и катод, написать электродные процессы.
102. К какому типу покрытий относятся олово на стали и на меди. Какие процессы будут протекать при атмосферной коррозии луженной стали и меди. Напишите уравнения анодных и катодных процессов.
103. В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка идет интенсивнее. Напишите уравнения анодных и катодных процессов.
104. Магний в контакте с хромом находится во влажном воздухе. Какой металл будет коррозировать? Напишите уравнения анодных и катодных процессов.
105. Как происходит коррозия алюминия в контакте с цинком в растворе хлороводородной кислоты. Напишите уравнения анодных и катодных процессов.
106. Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии если эта пара попадет в кислую среду (HCl). Дайте схему образующегося при этом гальванического элемента.
107. Олово спаяно с серебром. Какой из металлов будет коррозировать если эта пара попадет в щелочную среду. Напишите уравнения анодных и катодных процессов и составьте схему образующегося при этом гальванического элемента.
Таблица вариантов контрольных заданий
| № варианта | Номера задач | № варианта | Номера задач | |||||||||
Методические указания
к контрольным заданиям по дисциплине Химия
для студентов нехимических специальностей
заочной формы обучения. Часть III.
Составители: доцент к. х. н. Андрианова Л. И.
доцент к. х. н. Пнева А. П.
доцент, к. х. н., Обухов В. М.
Подписано к печати Бум. Писч. № 1
Заказ № Уч. издл. л.
Формат 60/90 1/16 Тираж экз.
Отпечатано на RISO GR 3750
Издательство «Нефтегазовый университет»
Государственное образовательное учреждение высшего профессионального образования
«Тюменский государственный нефтегазовый университет»
625000, г. Тюмень, ул. Володарского, 38
Отдел полиграфии издательства «Нефтегазовый университет»
625000, г. Тюмень, ул. Володарского, 38
