Термодинамика изучает законы обмена энергии между системой и окружающей средой.
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
Для проведения лекционного занятия
по дисциплине «Химия»
для курсантов 1 курса по специальности 280705.65 –
«Пожарная безопасность»
РАЗДЕЛ II
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ
ХИМИЧЕСКИХ ПРОЦЕССОВ
ТЕМА 2.8
ТЕРМОДИНАМИКА ХИМИЧЕСКИХ ПРОЦЕССОВ
ЗАНЯТИЕ № 2.8.1
ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ.
ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Обсуждена на заседании ПМК
протокол №__ от «___»________2014г.
Владивосток
2014 г.
I. Цели занятия
Учебные: Введение в химическую термодинамику. Знакомство с терминологией и основными термохимическими законами
Воспитательная: воспитывать у обучаемых ответственность за подготовку к практической деятельности.
II. Расчет учебного времени
| Содержание и порядок проведения занятия | Время, мин |
| ВВОДНАЯ ЧАСТЬ | |
| ОСНОВНАЯ ЧАСТЬ | |
| Учебные вопросы | |
| 1. Основные понятия химической термодинамики | |
| 2. Первый закон термодинамики | |
| 3. Понятие энтальпии | |
| 4. Термохимические законы | |
| ЗАКЛЮЧИТЕЛЬНАЯ ЧАСТЬ |
III. Литература
Основная
1. Глинка Н.Л. Общая химия: Учебное пособие для вузов/ Под ред. А.И. Ермакова. – изд. 30-е, исправленное-М.: Интеграл-Пресс, 2007.-728 с.
2.Е.Г. Коробейникова, А.П. Чуприян, В.Р. Малинин, Г.К. Ивахнюк, Н.Ю. Кожевникова. Химия. Курс лекций Учебное пособие по спец. 280104.65 – Пожарная безопасность. /Под ред. Проф. В.С.Артамонова /СПб.: Санкт-Петербургский университет ГПС МЧС России, 2008 г. – 425 с.
3. Некрасов Б.В. Основы общей химии. – 4-е изд.,- СПб: Изд-во «Лань», 2003. - 656 с.
Дополнительная
1. Суворов А.В., Никольский А.Б. Вопросы и задачи по общей химии., - СПб: Химиздат, 2002.- 304 с.
Нормативно-правовые документы
1. ГОСТ 12.1.004 – 89 . Пожаровзрывоопасность веществ и материалов. Номенклатура показателей и методы их определения.
2.СП 13130.2009. Определение категорий помещений, зданий и наружных установок по взрывопожарной и пожарной опасности.
3.Технический регламент о требованиях пожарной безопасности. Федеральный закон №123-ФЗ.- Москва: Изд-во «Проспект», 2010. -139 с.
IV. Учебно-материальное обеспечение
1.Технические средства обучения: компьютерная техника ( РМП, П), интерактивная доска.
2. Периодическая система элементов Д.И. Менделеева, демонстрационные плакаты, схемы.
V. Текст лекции
Тема 8.1. ОСНОВЫ ТЕРМОХИМИИ
ВВОДНАЯ ЧАСТЬ (3 мин.)
Преподаватель проверяет наличие слушателей (курсантов), объявляет тему, учебные цели и вопросы занятия.
ОСНОВНАЯ ЧАСТЬ ( 85 мин)
Вопрос № 1. Основные понятия термодинамики (20 мин.)
Термодинамика изучает законы обмена энергии между системой и окружающей средой.
Возникновение термодинамики как самостоятельной дисциплины относится к середине 19 века. В первый период своего развития термодинамика изучала соотношение только между тепловой и механической энергией. Позднее в круг вопросов, которые рассматривает термодинамика, включались и другие вновь открываемые формы энергии (электрическая, химическая и т.д.). Быстро расширялась область практического применения термодинамических методов исследования. Эти методы применялись при изучении самопроизвольных процессов при электролизе, при химических реакциях, в атмосферных явлениях, а также в некоторых процессах, протекающих в животных и растительных организмах. Быстрое развитие прикладных направлений термодинамики привело к выделению их в самостоятельные разделы. Так возникла и наука "химическая термодинамика".
Предметом химической термодинамики служит термодинамическое рассмотрение химических явлений.
Определим основные понятия.
Энергия– это мера взаимодействия и движения материальных систем. Другими словами, энергия– это способность совершать работу.
Выполняя любой эксперимент, мы имеем дело с системой– изолированной или ограниченной частью вселенной. Система – это совокупность тел, которая фактически или мысленно выделяется из окружающей среды и подвергается экспериментальному или теоретическому изучению. Если проводим реакцию в стакане, системой является содержимое химического стакана, а не сам стакан.
Стакан, воздух и все окружающие предметы называются окружающей (внешней) средой.
Различают системы изолированные, закрытые и открытые.
| Система | ||
| Изолированная | Закрытая | Открытая |
| Не обменивается с внешней средой ни веществом, ни энергией | Обменивается с внешней средой только энергией | Обменивается с внешней средой и веществом, и энергией |
| Пример: запаянная и изолированная ампула | Пример: газ в закрытом баллоне | Пример: жидкость в открытом стакане |
Свойства систем могут быть интенсивные и экстенсивные.
| Свойства систем | |
| Экстенсивные (суммирующиеся) | Интенсивные (выравнивающиеся) |
| Пример: масса, объем энергия | Пример: температура, давление, концентрация |
Обмен энергией между системой и окружающей средой может осуществляться в различных формах. Форм энергии много: тепловая, механическая, ядерная, химическая, световая и др., но существует всего 2 типа энергии: кинетическая (энергия движущегося тела) и потенциальная ( энергия, приобретенная в результате изменения телом и его частями положения в пространстве).
Формы энергии
Тепловая энергия – наиболее известная форма, вид кинетической энергии. Тепловая энергия связана с движением атомов и молекул. Теплотой называют неупорядоченную форму передачи энергии, в отличие от работы – упорядоченной формы передачи энергии.
В соответствии с Техническим регламентом о требованиях пожарной безопасности.Федеральный закон № 123-ФЗ Статья 2. П.29. Пожаровзрывоопасность веществ и материалов – способность веществ и материалов к образованию горючей среды, характеризуемая их физико-химическими свойствами и (или) поведением в условиях пожара.
.
Примеры тепловой энергии известны всем: холодные и горячие предметы, энергия, которая выделяется в химических реакциях, энергетические эффекты фазовых переходов.
Нельзя путать тепловую энергию и температуру. Теплота – это форма энергии, а температура – условная мера теплового состояния.
Единица тепловой энергии 1 калория. 1 кал – количество тепла, необходимое для повышения температуры 1 г воды на 10
В химических реакциях участвуют, как правило, механическая и тепловая формы энергии. Точно установлен и механический эквивалент калории.
1 калория = 4, 184 Дж.
В настоящее время в качестве единицы любой энергии используется единица Дж – джоуль.
1 Дж = 1 Н×м = 
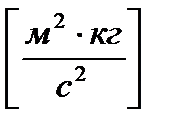 .
.
(1 Джоуль – это маленькая величина. Для того, чтобы оценить единицу Дж, можно привести следующие данные.
1 Дж – это такое количество тепла, которое позволяет нагреть 1 мл (см3) воды на 0,250. Чаще используют единицу в 1000 раз больше Дж -
кДж - килоджоуль.
Для того, чтобы вскипятить 1, 5 л воды требуется 500 кДж.
А для того, чтобы выпарить 1,5 л воды необходимо 3000 кДж
Энергия некоторых химических реакций значительна. Так, при сжигании всего 12 г угля выделяется 400 кДж тепла.)
2. Механическая энергия существует в нескольких видах, но основные – потенциальная и кинетическая энергии.
3. Электрическая энергия определяется тремя факторами - напряжением (U, В), силой тока (I, A) и временем его протекания (t, c).
Главным образом с этими формами энергии мы имеем дело в химической термодинамике.
Параметры состояния – это переменные величины, определяющие состояние системы. Так состояние газа можно определить с помощью параметров состояния – температуры, давления и объема.
Термодинамические функции состояния характеризуют состояние системы и происходящие с ней изменения.
К термодинамическим функциям состояния относятся:
| Термодинамические функции состояния | ||
| Функция | Обозначение | Размерность |
| Внутренняя энергия | U | кДж/моль |
| Энтальпия | H | кДж/моль |
| Энтропия | S | Дж/моль×К |
| Изобарно-изотермический потенциал (энергия Гиббса) | G | кДж/моль |
Основное свойство любой функции состояния – независимость ее изменения от способа или пути изменения состояния системы.
Например, пусть значение внутренней энергии изменяется от U1 до U2.
Такое изменение может происходить различным путем.
Напрямую: U1 ® U2; через промежуточные стадии: U1 ® U3 ® U4 ® U2.
Изменение внутренней энергии DU не зависит от любых промежуточных стадий процесса, а определяется только начальным и конечным состоянием системы, т.е. в обоих случаях DU = U2 - U1 или DU = UКОНЕЧН - UНАЧ
В термодинамике рассматриваются различные виды процессов.
| Процессы | ||
| Изобарные | Изохорные | Изотермические |
| р = const | V = const | T = const |
| Процессы, протекающие в открытых сосудах или на открытом воздухе. | Процессы, протекающие в замкнутых объемах (например, в закрытых технологических аппаратах). | Процессы, протекающие при постоянной температуре. |
(Все определения, формулы, графики и уравнения реакций даются под запись.)
