Защита металлов от коррозии
Лекция 15
Коррозия металлов
Основные виды коррозии. Классификация коррозионных процессов. Химическая коррозия. Электрохимическая коррозия.
Коррозия — это разрушение металлов в результате его физико-химического взаимодействия с окружающей средой. При этом металлы окисляются и образуются продукты коррозии, состав которых зависит от условий коррозии.
Коррозия — самопроизвольный процесс и соответственно протекает с уменьшением энергии Гиббса системы. Химическая энергия реакции коррозионного разрушения металлов выделяется в виде теплоты и рассеивается в окружающем пространстве.
Химическая коррозия, характерна для сред, не проводящих электрический ток. При химической коррозии происходит прямое гетерогенное взаимодействие металла с окислителем окружающей среды.
Химическая коррозия, характерна для сред, не проводящих электрический ток. При химической коррозии происходит прямое гетерогенное взаимодействие металла с окислителем окружающей среды. По условиям протекания коррозионного процесса различают: а) газовую коррозию—в газах и парах без конденсации влаги на поверхности металла, обычно при высоких температурах. Примером газовой коррозии может служить окисление металла кислородом воздуха при высоких температурах; б) коррозию в неэлектролитах — агрессивных органических жидкостях, таких, как сернистая нефть и др.
Рассмотрим химическую коррозию в газах (газовая коррозия), в частности коррозию в атмосфере кислорода. Уравнение реакции окисления металлов кислородом можно записать в общем виде
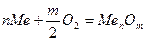
В соответствии с законами химической термодинамики эта реакция, как и другие реакции коррозии, может протекать лишь при условии уменьшения энергии Гиббса системы, т. е. при условии, если энергия Гиббса ниже нуля: 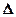 G<0. Так как, по определению, энергия Гиббса образования простых веществ равна нулю, то энергия Гиббса окисления металлов равна энергии Гиббса образования оксидов. Энергию Гиббса реакции окисления металлов рассчитывают по уравнению
G<0. Так как, по определению, энергия Гиббса образования простых веществ равна нулю, то энергия Гиббса окисления металлов равна энергии Гиббса образования оксидов. Энергию Гиббса реакции окисления металлов рассчитывают по уравнению
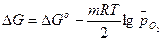 ,
,
где 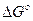 - стандартная энергия гиббса реакции;
- стандартная энергия гиббса реакции; 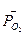 -относительное парциальное давление кислорода (р/100).
-относительное парциальное давление кислорода (р/100).
большинство металлов в атмосфере кислорода могут подвергаться химической коррозии. Однако термодинамика указывает лишь на возможность протекания процессов, но не может предсказать их скорость.
Электрохимическая коррозия характерна для сред, имеющих ионную проводимость. При электрохимической коррозии процесс взаимодействия металла с окислителем включает анодное растворение металла и катодное восстановление окислителя. Электрохимическая коррозия может протекать: а) в электролитах — в водных растворах солей, кислот, щелочей, в морской воде; б) в атмосфере любого влажного газа; в) в почве.
процессы электрохимической коррозии подобны процессам, протекающим в гальванических элементах. Основным отличием процессов электрохимической коррозии от процессов в гальваническом элементе является отсутствие внешней цепи. Электроны в процессе коррозии не выходят из корродирующего металла, а двигаются внутри металла. Химическая энергия реакции окисления металла передается не в виде работы, а лишь в виде теплоты. Окислители играют двойную роль в коррозионных процессах. С одной стороны, они могут восстанавливаться и этим ускорять коррозию металлов, а с другой (для металла, способного к пассивации) - вызвать пассивацию металла и резкое торможение коррозии. Обычно это наблюдается на металлах, способных пассивироваться, таких, как хром, алюминий, титан, цирконий, никель, тантал и др. Пассивностью металла называется состояние его повышенной коррозионной устойчивости, вызванное торможением анодного процесса.
Механизм электрохимической коррозии. Коррозия металлов в средах, имеющих ионную проводимость, протекает через анодное окисление металлов
Me0 - ne- 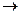 Me n+
Me n+
и катодное восстановление окислителя (Ox)
Ox + ne- 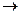 Red
Red
Наиболее часто при коррозии наблюдается восстановление молекул кислорода:
а) в нейтральной или щелочной среде: 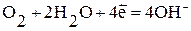 ;
;
б )в кислой среде: 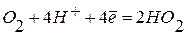 ;
;
и выделение водорода в кислой среде: 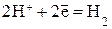 ,
,
Ионы или молекулы, которые восстанавливаются на катоде, называются деполяризаторами. При атмосферной коррозии - коррозия во влажном воздухе при комнатной температуре - деполяризатором является кислород (коррозия с кислородной деполяризацией). Коррозия с участием ионов водорода называется коррозией с выделением водорода (коррозия с водородной деполяризацией).
Пример 1.Как происходит коррозия цинка, находящегося в контакте с кадмием в нейтральном и кислом растворе. Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Решение. Цинк имеет более отрицательный стандартный электродный потенциал ( 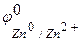 =-0,763 В), чем кадмий (
=-0,763 В), чем кадмий ( 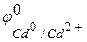 = -0,403 В), поэтому он является анодом, а кадмий – катодом, возникает микрогальванопара:
= -0,403 В), поэтому он является анодом, а кадмий – катодом, возникает микрогальванопара:
(А) Zn/ среда / Cd (К)
| Анодный процесс: | А: 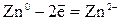 |
| Катодный процесс: а) в кислой среде б) в нейтральной среде | К: 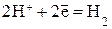 К: К: 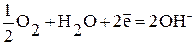 |
а) в кислой среде образуется соль цинка и газообразный водород
б) Так как ионы Zn2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом коррозии в нейтральной среде будет Zn(ОН)2.
ЭДС системы равна разности потенциалов окислителя и восстановителя:
Е. = 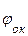 -
- 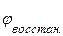 =
= 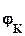 -
- 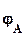 ,
,
то коррозия возможна при условии, что потенциал окислителя положительнее потенциала металла: 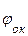 >
> 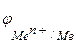 . Чем больше разность потенциалов, тем быстрее протекает коррозия, т.к. возрастает энергия Гиббса:
. Чем больше разность потенциалов, тем быстрее протекает коррозия, т.к. возрастает энергия Гиббса: 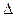 G = - E∙n∙F,
G = - E∙n∙F,
где Е - ЭДС (Е) элемента в [В]; n – число электронов, принимающих участие в электродном процессе, F = 96500 Кл/моль=96500 Дж/моль В – число Фарадея.
Если ЭДС элемента имеет положительное значение (Е>0), то коррозия возможна, т.к. 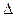 G < 0, а процесс протекает самопроизвольно.
G < 0, а процесс протекает самопроизвольно.
ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
Защита металлов от коррозии: легирование металлов, защитные покрытия, электрохимическая защита (протекторная), изменение свойств коррозионной среды, защита от коррозии блуждающими токами.
Коррозию металлов можно затормозить изменением потенциала металла, пассивированием металла, снижением концентрации окислителя, изоляцией поверхности металла от окислителя, изменением состава металла и др. Выбор способа определяется его эффективностью, а также экономической целесообразностью. Все методы защиты условно делятся на следующие группы: а) легирование металлов; б) защитные покрытия (металлические, неметаллические); в) электрохимическая защита; г) изменение свойств коррозионной среды; д) рациональное конструирование изделий.
Легирование металлов - эффективный (хотя и дорогой) метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивацию металла. В качестве таких компонентов применяют хром, никель, вольфрам и др. К коррозионностойким сплавам, например, относятся нержавеющие стали, в которых легирующим компонентом служат хром, никель, и другие металлы. содержание хром, кремний, молибдена (4-9%) улучшает жаропрочность стали, такие сплавы применяют в парогенераторо- турбостроении. Сплав, содержащий 9-12% хрома, применяет для изготовления турбин, деталей реактивных двигателей и т.п.
Защитные покрытия. Слои, искусственно создаваемые на поверхности металлических изделий и сооружений для предохранения их от коррозии, называются защитными покрытиями. Если наряду с защитой от коррозии покрытие служит также для декоративных целей, его называют защитно-декоративным. Выбор вида покрытия зависит от условий, в которых используется металл.
а) металлические покрытия. Материалами для металлических защитных покрытий могут быть как чистые металлы (цинк, кадмий, алюминий, никель, медь, хром, серебро и др.), так и их сплавы (бронза, латунь и др. По характеру поведения металлических покрытий при коррозии их можно разделить на катодные и анодные.
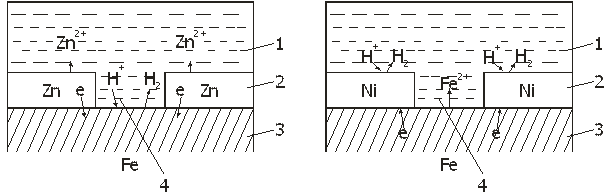
Ккатоднымпокрытиям относятся покрытия, потенциалы которых в данной среде имеют более положительное значение, чем потенциал основного металла. В качестве примеров катодных покрытий на стали можно привести Си, Ni, Ag. При повреждении покрытия (или наличии пор) возникает коррозионный элемент, в котором основной материал в поре служит анодом и растворяется, а материал покрытия — катодом, на котором выделяется водород или поглощается кислород (Рис. 1а). Следовательно, катодные покрытия могут защищать металл от коррозии лишь при отсутствии пор и повреждений покрытия.
анодныепокрытияимеют более отрицательный потенциал, чем потенциал основного металла. Примером анодного покрытия может служить цинк на стали. (Рис. 1б). В этом случае основной металл будет катодом коррозионного элемента, поэтому он не корродирует. Потенциалы металлов зависят от состава растворов, поэтому при изменении состава раствора может меняться и характер покрытия. Так, покрытие стали оловом в растворе H2SO4 - катодное, а в растворе органических кислот - анодное.
|
|
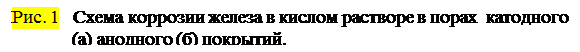
|
Для получения металлических защитных покрытий применяются различные способы:
- электрохимический (гальванические покрытия), погружение в расплавленный металл, металлизация, термодиффузионный и химический. Из расплава получают покрытие цинка (горячеецинкование) и олова (горячее лужение).
- химический способ получения металлических покрытий заключается в восстановлении соединений металла с помощью водорода, гидразина и других восстановителей.
в) К органическим покрытиям относятся лакокрасочные покрытия, покрытия смолами, пластмассами, полимерными пленками, резиной.
Лакокрасочные покрытия наиболее распространены и незаменимы. Лакокрасочное покрытие должно быть сплошным, беспористым, газо- и водонепроницаемым, химически стойким, эластичным, обладать высоким сцеплением с материалом, механической прочностью и твердостью.
г) В качестве неорганических покрытий применяют неорганические эмали, оксиды металлов, соединения хрома, фосфора и др.
- Образование на поверхности металлических изделий защитных оксидных пленок в технике называют оксидированием. Так, например, процессы нанесения на сталь оксидных пленок иногда называют воронением, а электрохимическое оксидирование алюминия — анодированием.
- Фосфатные покрытия на стали получают из растворов ортофосфорной кислоты и ортофосфатов марганца или цинка (например, ZnHPO4 + H3PO4). При реакции образуется пористый кристаллический фосфат металла, хорошо сцепленный с поверхностью стали. Сами по себе фосфатные покрытия не обеспечивают достаточной защиты от коррозии. Их используют в основном в качестве подложки под краску, что повышает сцепление лакокрасочного покрытия со сталью и уменьшает коррозию в местах царапин.
Электрохимическая защита (протекторная) осуществляется присоединением к защищаемой конструкции металла с более отрицательным значением электродного потенциала. Такие металлы называются протекторами.Вспомогательный электрод (анод) растворяется, на защищаемом сооружении (катоде) выделяется водород.Для их изготовления большей частью используют магний и его сплавы, цинк, алюминий.
Наиболее применима электрохимическая защита в коррозионных средах с хорошей ионной электрической проводимостью. Сущность катодной защиты заключается в том, что защищаемое изделие подключается к отрицательному полюсу внешнего источника постоянного тока, поэтому оно становится катодом, а анодом служит вспомогательный, обычно стальной электрод. Катодная поляризация используется для защиты от коррозии подземных трубопроводов, кабелей. Катодную защиту применяют также к шлюзовым воротам, подводным лодкам, водным резервуарам, морским трубопроводам и оборудованию химических заводов.
Изменение свойств коррозионной среды.Для снижения агрессивности среды уменьшают концентрацию компонентов, опасных в коррозионном отношении. Например, в нейтральных средах коррозия обычно протекает с поглощением кислорода. Его удаляют деаэрацией (кипячение, барботаж инертного газа) или восстанавливают с помощью соответствующих восстановителей (сульфиты, гидразин и т. п.). Агрессивность среды может уменьшаться также при снижении концентрации ионов Н+, т. е. повышении рН (подщелачивании). Для защиты от коррозии широко применяют ингибиторы.
Ингибитором называется вещество, при добавлении которого в среду, где находится металл, значительно уменьшается скорость коррозии металла. К анодным замедлителям нужно отнести замедлители окисляющего действия, например нитрит натрия NaNО2, дихромат натрия Na2Cr2O7. К катодным ингибиторам относятся органические вещества, содержащие азот, серу и кислород, например диэтиламин, уротропин, формальдегид, тиокрезол.
Защита от коррозии блуждающими токами.Токи, ответвляющиеся от своего основного пути, называются блуждающими. Источниками блуждающих токов могут быть различные системы и устройства, работающие на постоянном токе, например железнодорожные пути электропоездов, заземления постоянного тока, установки для электросварки, электролизные ванны, системы катодной защиты и т. д.
Коррозия металлов под влиянием электрического тока от внешнего источника называется электрокоррозией. В качестве примера рассмотрим электрокоррозию подземного трубопровода во влажной почве. Схема возникновения блуждающего тока от трамвайной линии, где стальные рельсы используются для возвращения тока к генераторной станции. Борьба с коррозией блуждающими токами заключается, прежде всего, в их уменьшении. Для электрифицированных железных дорог, у которых рельсы служат обратными проводами, это достигается поддержанием в хорошем состоянии электрических контактов между рельсами и увеличением сопротивления между рельсами и почвой.
