Защита металлов от коррозии.
Самым оптимальным решением проблемы защиты металлов от коррозии была бы полная замена металлов, подверженных коррозии, на коррозионно-устойчивые металлы, сплавы, полимерные материалы. В настоящее время такие материалы применяются выпускаются, но они или дороги, или по своим физико-механическим свойствам не удовлетворяют всем требованиям промышленности. Поэтому, не смотря на широкое применение полимерных материалов, основными конструкционными материалами являются металлы. Методы защиты от коррозии основаны на следующих принципах:
1. Изоляция металла от воздействия внешней агрессивной среды.
Это осуществляется за счет следующих мероприятий:
- покрытия металла поверхностными пассивирующими пленками
из его нерастворимых соединений, которые образуются при фосфатировании, оксидировании, азотировании и т.д.;
- создание защитных покрытий из слоев смазки, битумов,
красок, эмалей:
- нанесение покрытий из других металлов.
По способу защитного действия и электрохимическим свойствам покрытия металлами делятся на катодные и анодные.
Анодное покрытие – электронный потенциал металл анодного покрытия в данной среде меньше потенциала защищаемого металла. В качестве анодного покрытия для стали используют цинк, кадмий и др. При нарушении целостности покрытия разрушается само покрытие.
Анодные покрытия защищаю главным образом электрохимически, поэтому степень пористости анодного покрытия не играет существенного значения пример растворения цинкового покрытия на железе.
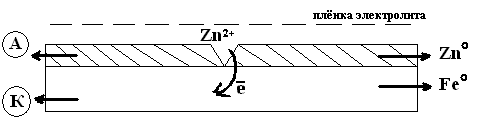
Рис. 1
Если электролит имеет кислую среду (pH<7), то в возникшем гальваническом элементе протекают следующие реакции:
Анод: Zn°-2е→Zn2+
Катод: 2H++2е→H20
 Zn0 + 2H+= Zn2++H20
Zn0 + 2H+= Zn2++H20
Если pH>=7(например, морская вода), то окислителем является кислород и происходят следующие процессы:
 Анод: Zn°-2е→ Zn2+ 2
Анод: Zn°-2е→ Zn2+ 2
Катод:  О2+2Н2О+4е→4ОН
О2+2Н2О+4е→4ОН 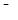 1
1
 2Zn + О2+2Н2О = 2Zn(OH)2
2Zn + О2+2Н2О = 2Zn(OH)2
Анодное покрытие защищает металл до тех пор, пока не будет разрушен практически весь слой цинка.
Катодное покрытие –электронный потенциал металлопокрытия φкп больше потенциала защищаемого металла φме (φме < φкп).
К катодным покрытиям относятся лужение, меднение, никелирование и др. Рассмотрим случай покрытия железа оловом.
φ0 Sn/Sn2+ = -0.136В
φ0 Fe/Fe2+ = -0.44В
В возникшем гальваническом элементе протекают реакции:
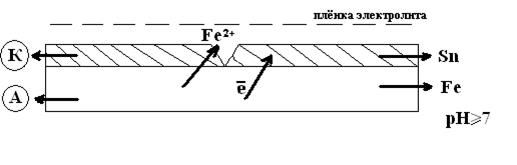
Рис. 2
Анод: Fe°-2е→ Fe2+
 Катод:
Катод:  О2+2Н2О+4е→4ОН
О2+2Н2О+4е→4ОН 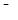
2Fe + О2+2Н2О = 2Fe(OH)2
Под действием кислорода и воды далее протекает реакция:
4Fe(OH)2+ О2+2Н2О↔4Fe(OH)3
При катодном покрытии металл предохраняется до тех пор, пока не нарушена сплошность покрытия, а при её нарушении основной металл разрушается более интенсивно, чем без защиты, при этом создаётся благоприятные условия для язвенной коррозии. На практике чаще применяются катодные покрытия, т.к. во многих агрессивных средах они имеют значительно меньшую скорость собственной коррозии, чем анодные покрытия.
2. Создание такой электрохимической системы, в которой защищаемая конструкция станет катодом и на ней будет протекать катодный процесс восстановления деполяризатора. К электрохимическим методам защиты относятся катодная, протекторная, анодная защиты. Последняя в судостроении пока не находит применения. Принцип действия протекторной защиты аналогичен действию анодного покрытия. В качестве протектора-“жертвенного анода”, как его называют в иностранной литературе, используются металлы с более электроотрицательным потенциалом, чем у защищаемого металла, чаще всего: алюминий, магний, цинк и их сплавы. Чем больше разность потенциалов в паре “основной металл-протектор”, тем больше защитный эффект. К борту судна, например, присоединяется протектор и образуется гальваническая пара, в которой катодом является металл корпуса судна.
Катодная защита осуществляется с помощью внешнего источника постоянного тока; эта защита основана на использовании основных законов процесса электролиза: защищаемая деталь подключается к отрицательному полюсу источника тока, становится катодом, анодом служит или растворимый, или нерастворимый электрод. Применение растворимого анода (чугун, сталь и др.) приводит к окислению его. При использовании нерастворимого анода на нем протекает процесс окисления воды:
2Н2О-4е→ О2+4Н+
Для катодной защиты корпуса корабля применение растворимых анодов не эффективно, так как процесс их замены - громоздкая и дорогая операция. Поэтому в судостроении применяются нерастворимые аноды, имеющие титановое основание, платиновую фольгу, и экран из стеклопластика.
3. Снижение агрессивности среды за счет введения ингибиторов, т.е. веществ, замедляющих, тормозящих катодный и анодный процессы.
В качестве ингибиторов коррозии применяются неорганические вещества, тормозящее действие которых, как полагают, связано с окислением" поверхности металла (нитраты, хроматы) или с образованием пленки нерастворимого соединения металла с данным ионом и, возможно, кислородом (фосфаты, гидрофосфаты). Неорганические ингибиторы тормозят преимущественно анодную реакцию.
В качестве ингибиторов широко применяются также органические вещества, содержащие амино-, тио-, карбоксо-гругшы и некоторые другие. Защитное действие органических ингибиторов связано с их адсорбцией на поверхности металла: В результате адсорбции наблюдается торможение анодного и катодного процессов и снижение скорости коррозии. Необходимо отметить, что наиболее эффективны комбинированные методы защиты. Такие методы сочетают в себе одновременное применение различных способов защиты:
-покрытие металлами + окраска;
-окраска + катодная защита;
-окраска + протекторная защита;
-окраска с введением в краситель ингибитора.
Суммарный эффект комбинированной защиты часто выше арифметической суммы эффектов отдельных способов.
ОБЪЕКТ ИССЛЕДОВАНИЯ.
Электрохимическая коррозия металлов и методы защиты металлов от коррозии.
КОНТРОЛЬНЫЕ ВОПРОСЫ.
1.Составить схему коррозийного элемента и написать уравнения реакции, протекающих при наличии повреждений свинцовой оболочки стального кабеля подводной линии связи.
2. Для защиты контактов из серебра и других чувствительных к сероводороду материалов применяют гальванические покрытия из золота. Какие процессы будут протекать на серебряных контактах плат при нарушении сплошности покрытия из золота во влажной атмосфере?
3. Какие покрытия на металлах относятся к неметаллическим неорганическим?
4. Какие вещества называют ингибиторами коррозии?
5. Приведите примеры использования контактных и летучих ингибиторов атмосферной коррозии.
6. Можно ли использовать смесь нитрата натрия со щёлочью для защиты внутренних поверхностей трубопроводных систем парогенераторов?
