Схемы и механизмсульфирования аренов
Сульфирование аренов может быть представлено следующими химическими схемами (в зависимости от используемого сульфирующего агента):


Сульфирование ароматических соединений является реакцией электрофильного замещения (SE) и обычно протекает по схеме:
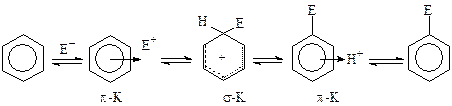
Отличием этой реакции от других реакций SE является ее обратимость, которая в наибольшей степени проявляется лишь в концентрированной серной кислоте. Выделяющаяся реакционная вода способствует диссоциации серной и сульфоновой кислот с образованием протона (электрофила), что приводит к десульфированию. В случае олеума и сульфотриоксида концентрация протона крайне низка и реакция сульфирования практически необратима.
Скорость и направление реакции в большой степени определяется строением субстрата, т. е. устойчивостью s-комплекса (кинетический фактор), однако при сульфировании серной кислотой направление реакции может зависеть и от устойчивости продуктов реакции (термодинамический фактор)
Электронодонорные (Д) заместителив арене облегчают прохождение реакции, а электроноакцепторные (А) — затрудняют.

Сульфирующими частицами являются поляризованные молекулы и катионы Н3SO4+ < SO3, S2O6, S3O9 < НSO3+ (в порядке возрастания активности), которые имеются в серном ангидриде или образуются в олеуме и при диссоциации кислоты:
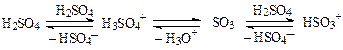
Молекулы органического соединения могут одновременно взаимодействовать с различными сульфирующими частицами, т.е. реакция может протекать по нескольким схемам.
Сама H2SO4 не является электрофилом и не способна сульфировать органические соединения. Если при сульфировании арена концентрированной серной кислотой в реакционную массу добавить сульфат натрия, скорость сульфирования резко падает и при определенной концентрации соли процесс останавливается. Считается, что соль подавляет диссоциацию H2SO4, и сульфирующие частицы не образуются.
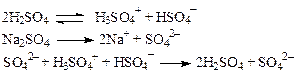
Тепловой эффектсульфированияаренов серной кислотой, рассчитанный по закону Гесса, относительно невелик (73 кДж/моль), так как он является суммой экзотермического процесса взаимодействия SO3 с субстратом и эндотермического — диссоциации H2SO4 с образованием SO3. В реальном процессе он в 1,5—2 разавыше рассчитанного, за счет теплоты, выделяющейся при разбавлении серной кислоты реакционной водой. Тепловой эффект сульфирования серным ангидридом (олеумом) высок и составляет около 200 кДж/моль(нет затрат на образование SO3).
