S2s2p3s3p4s3d4ps3d4p5s4d5p6s4f5d6p7s5f6d7р
Правило Гунда: при данном значении l (т. е. в пределах определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным.
Например, в трех р-ячейках три электрона будут располагаться таким образом:
1. ↑ ↑ ↑ , а так же 2. 3 ↑↓ ↑
Р Р
Потому что в первом случае суммарное спиновое число равно
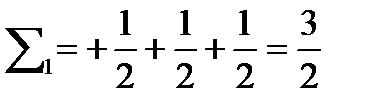
Во втором случае
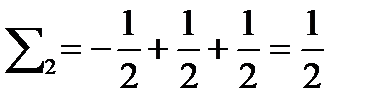 , т.е.
, т.е. 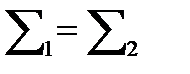 ,
,
Что отвечает правилу Гунда.
Выводы:
Принципы размещения электронов в атоме:
1.Принцип (запрет) Паули (1925 г.): «В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел». Поэтому на одной орбитали не может быть двух электронов
2.Порядок заполнения электронами атомных орбиталей определяет принцип наименьшей энергии (принцип минимума энергии).
Энергия электрона в основном определяется главным квантовым числом n и побочным квантовым числом l, поэтому сначала заполняются те подуровни, для которых сумма значений квантовых чисел n и l является наименьшей.
n + l → min
Если для двух подуровней суммы значений равны, то сначала заполняется подуровень с меньшим значением n (правило Клечковского).
Принцип наименьшей энергии справедлив для основных состояний атомов.
Электронная формула:
S2s2p3s3p4s3d4ps3d4p5s4d5p6s4f5d6p7s5f6d7р
3.Правило Гунда: при данном значении l (т. е. в пределах определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным.
ЭЛЕКТРОННЫЕ ФОРМУЛЫ.
Распределение электронов в атоме записывается в виде электронных формул. В них буквами s, p, d и f обозначаются подуровни электронов, цифры впереди букв означают энергетический уровень, в котором находится данный электрон, а индекс вверху справа – число электронов на данном подуровне. Сумма показателей степеней при символах орбиталей должна равняться порядковому номеру элемента, т. е. числу электронов в электронной конфигурации атома. Например, запись 3s1 означает: 3 – номер энергетического уровня, s – подуровень, на s1 – подуровне размешается один электрон.
Чтобы составить электронную формулу атома любого элемента достаточно знать номер данного элемента в периодической системе Д. И. Менделеева и выполнить основные положения, которым подчиняется распределение электронов в атоме.
Структура электронной оболочки атома может быть изображена в виде схемы размещения электронов по энергетическим ячейкам (электронно-графическая формула).
Электронно-графическая формула атомов показывает распределение электронов по орбиталям и спины электронов.
5В 1s22s22p1 2 ↑↓ ↑
1 ↑↓ s
P
Выводы:
1. Распределение электронов в атоме записывается в виде электронных формул.
2. Чтобы составить электронную формулу атома любого элемента достаточно знать номер данного элемента в периодической системе Д. И. Менделеева
3. Структура электронной оболочки атома может быть изображена в виде схемы размещения электронов по энергетическим ячейкам (электронно-графическая формула).
