Сильные и слабые электролиты
различают «сильные электролиты» и «слабые электролиты»:
(для 0,1М растворов)«сильные» a>0,3(30%), «слабые» a<0,03(3%), «средние» a=0,3-0,03(3-30%)
ПР: «сильные» – соли(!малорастворимые соли)
щелочи Са(ОН)2
многие неорганические кислоты
«слабые» - почти все органические кислоты
многие неорганические кислоты
многие основания + NH4OH, H2O
Ступенчатая диссоциация.
многоосновные кислоты диссоциируют ступенчато
ПР: H2SO4 ® H+ + HSO4- a1
HSO4- Û H+ + SO42- a2< a1
снижение степени диссоциации определяется
- накоплением ионов и смещением динамического равновесия,
- большими затратами энергии на отрыв H+от иона HSO4-, чем затраты энергии на отрыв H+от H2SO4
многокислотные основания диссоциируют ступенчато..
331)константа диссоциации.константа диссоциации слабых электролитов зависит от…
слабые электролиты диссоциируют неполностью
при электролитической диссоциации слабых электролитов устанавливается хим.равновесие
хим.равновесие – состояние системы реагирующих в-в, где скорости «прямой» и «обратной» реакций равны
при электролитической диссоциации слабых электролитов справедлив закон действующих масс
 при Т=const скорость хим.реакции пропорциональна произведению молярных концентраций реагирующих в-в,
при Т=const скорость хим.реакции пропорциональна произведению молярных концентраций реагирующих в-в,
взятых в степенях равных коэффициентам в-в в уравнении хим.реакции
ПР: СН3СООН Û H+ + СН3СОО-
u1=k1С(СН3СООН) u2=k2С(H+) С(СН3СОО-)
u1=u2 k1С(СН3СООН) = k2С(H+) С(СН3СОО-) k1[СН3СООН] = k2[H+][СН3СОО-]
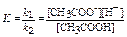 |
, где K – константа равновесия реакции диссоциации или константа
Диссоциации
ПР: константа диссоциации хлорноватистой кислоты..
константа диссоциации слабых электролитов зависит от природы р-теля, электролита, температуры:
- чем полярнее р-тель и активнее диссоциация, тем больше константа диссоциации
- чем сильнее электролит и активнее диссоциация, тем больше константа диссоциации
- чем выше температура и активнее диссоциация, тем больше константа диссоциации
соотношение констант диссоциации в многоступенчатом процессе рассчитывают по формуле
К = К1× К2× К3, причем К1 >К2 >К3
ПР: константы диссоциации фосфорной кислоты для всех ступеней процесса..
слабые электролиты диссоциируют неполностью
факторы, влияющие на степень диссоциации слабых электролитов
- при разведении р-ра степень диссоциации слабых электролитов увеличивается
*закон Освальда для слабых электролитов
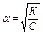
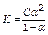
, если a<<1, то
ПР: на примере уксусной кислоты..
- при добавлении в р-р слабого электролита
сильных электролитов с общими ионами - константа диссоциации уменьшается,
сильных электролитов, не имеющих общие ионы,- константа диссоциации зависит от ионной силы р-ра
при растворении малорастворимых солей и малорастворимых оснований их молекулы распадаются на ионы
в насыщенном р-ре таких электролитов устанавливается равновесие между в-вом в осадке и ионами в растворе
ПР: AgClтв Û Ag+ + Cl-
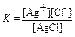 константа такого равновесия имеет вид (в общем случае нужно учитывать коэффициенты равновесной реакции)
константа такого равновесия имеет вид (в общем случае нужно учитывать коэффициенты равновесной реакции)
концентрация твердого AgClтв не меняется, поэтому константа равновесия имеет вид
К = [Ag+]× [Cl-]=ПР
в насыщенном р-ре электролита произведение концентраций его ионов называют произведением растворимости
345) Причинырастворения осадков Мg(ОН)2 и Аl2S3 в соляной кислоте
339)произведение растворимости – постоянная величина для данной температуры
ПР: произведения растворимости малорастворимых электролитов Са3(РО4)2 Аl(ОН)3 СuS
произведение растворимости указывает на растворимость или выпадение осадка электролита:
если произведение концентраций ионов электролита меньше произведения растворимости, то р-р ненасыщенный
в ненасыщенном р-ре осадок электролита растворится
если произведение концентраций ионов электролита равно произведению растворимости, то р-р насыщенный
в насыщенном р-ре осадок электролита не растворится, находясь в равновесии с раствором
если произведение концентраций ионов электролита больше произведения растворимости, то р-р перенасыщенный
в перенасыщенном р-ре ионы электролита выпадут в осадок
ПР: образование осадка Мg(ОН)2 при добавлении НСl МgSO4 NаОН Nа2SO4
ПР: растворение осадков Мg(ОН)2 и Аl2S3 в соляной кислоте
334)сильных электролитов335)кажущаяся степень диссоциации.
сильные электролиты диссоциируют полностью
образующиеся ионы окружаются сольватной(гидратной) оболочкой из полярных молекул растворителя(воды)
*Дебай-Гюккель
ионы в растворах электролитов взаимодействуют между собой
образующиеся ионы окружаются оболочкой из ионов электролита противоположного знака
в итоге, р-р сильного электролита представляет собой сложную систему ионов, окруженных оболочками противоионов
оболочки тормозят движение ионов в электрическом поле при пропускании тока ч/з р-р электролита
степень электролитической диссоциации, рассчитанная по электропроводности р-ра, оказывается ниже реальной
такая расчетная степень диссоциации есть "кажущаяся степень диссоциации"
