Обработка экспериментальных данных. 1. Заполнить таблицу 5. Зависимость скорости реакции от концентрации тиосульфата натрия
Опыт 1
1. Заполнить таблицу 5. Зависимость скорости реакции от концентрации тиосульфата натрия
Таблица 5.
| № пробирки | С(Na2S2O3) (относительные единицы) | lnCотн = ln(Ci/C1) | Время реакции t, с | lnτ |
| 0,693 | ||||
| 1,10 |
2. По данным таблицы построить график зависимости в координатах ln τ = ƒ(lnCотн). Для этого нанести экспериментально полученные точки на график и провести аппроксимирующую прямую (то есть прямую, которая проходила бы как можно ближе к экспериментальным точкам). Определить тангенс угла наклона этой прямой. Найти порядок реакции по тиосульфату натрия, равный значению тангенса угла наклона, взятому с обратным знаком. Округлить полученное значение порядка реакции до целого числа.
Опыт 2
1. По экспериментальным данным заполнить таблицу 6.
Зависимость скорости реакции от температуры
Таблица 6.
| № п/п | Температура T, K | Время реакции t, с | g | Ea, кДж/моль | |
| T1 | g1 | Ea, 1 | |||
| T2 | |||||
| g2 | Ea, 2 | ||||
| T3 |
2. Значение температурного коэффициента (коэффициента Вант-Гоффа) рассчитать, исходя из формулы:
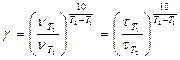 ,
,
рассматривая попарно Т2 − Т1 и Т3 − Т2.
3. Значение энергии активации рассчитать исходя из формулы:
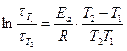 ,
,
рассматривая попарно Т2 − Т1 и Т3 − Т2.
4. Определить среднее значение коэффициента Вант-Гоффа gср.
5. Определить среднее значение энергии активации Ea, ср.
Содержание отчета по лабораторной работе
1. Название работы
2. Цель работы
3. Опыт 1
Экспериментальные данные (ход эксперимента, таблицы). Обработка экспериментальных данных (таблица, график, расчеты, значение порядка реакции по Na2S2O3). Вывод по опыту 1.
4. Опыт 2
Экспериментальные данные (ход эксперимента, таблица). Обработка экспериментальных данных (таблица, расчеты). Вывод по опыту 2.
5. Опыт 3
Экспериментальные данные (ход эксперимента, таблица). Написать уравнения реакций взаимодействия хлорида железа (III) с тиоцианат калия, в результате которого образуется Fe(SCN)3 красного цвета и восстановления железа (III) в железо (II) тиосульфатом натрия, протекающую по уравнению:
2Fe(SCN)3 + 2Na2S2O3 = Na2S4O6 + 2Fe(SCN)2 + 2NaSCN
Что являлось катализатором в данном опыте?
Вывод по опыту 3.
7. Опыт 4
Экспериментальные данные (ход эксперимента, таблица). Написать уравнения реакции взаимодействия хлорида железа (III) с тиоцианатом калия, в результате которого образуется Fe(SCN)3 красного цвета.
Как смещается равновесие при добавлении к реакционной системе хлорида железа и роданида аммония? Какой из реагентов больше смещает равновесие реакции в сторону образования продуктов реакции? Почему? Как влияет на положение равновесия добавление в систему тиоцианата аммония? В какую сторону смещается равновесие реакции?
Вывод по опыту 4.
