Вторичная структура белков
Пептидная цепь обладает значительной гибкостью. В результате внутрицепочечных взаимодействий она приобретает определённую пространственную структуру (конформацию), которая и называется вторичной. Вторичная структура белков стабилизируется за счёт образования водородных связей между карбонильной группой одного аминокислотного остатка и NH-группой другого:
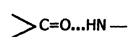
Чем больше образуется водородных связей, тем устойчивее вторичная структура. Но возможности пространственной укладки пептидной цепи ограничены тем, что пептидная связь имеет частично двойной характер и вращение вокруг неё невозможно. Атомы водорода и кислорода пептидной группы занимают транс-положение. Напротив, в области связей между пептидными группами и α-углеродными атомами возможно свободное вращение:
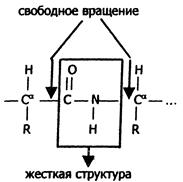
Вследствие этих ограничений при образовании водородных связей полипептидная цепь принимает не произвольную, а определенную конформацию. Известны три основных типа вторичной структуры белков: α-спираль, β-структура (складчатый слой) и беспорядочный клубок. В α-спирали NH-группа данного остатка аминокислоты взаимодействует с С=О-группой четвертого от него аминокислотного остатка. В результате образуется спираль, закрученная по часовой стрелке вследствие L-аминокислотного состава белков и содержащая на каждый виток 3,6 аминокислотных остатка. На один аминокислотный остаток приходится 0,15 нм, угол подъема спирали равен 26 градусов (рис. ниже). Витки спирали связаны водородными связями, ориентированными вдоль оси спирали, α-радикалы направлены наружу. Различные белки имеют различную степень спирализации: отношение числа аминокислот в спирали к общему числу минокислот в белке.
В складчатом слое (β-структуре) пептидные цепи (или отдельные участки одной цепи) располагаются параллельно друг другу в один слой, образуя фигуру, подобную листу, сложенному гармошкой. Причём возможны варианты β-структур: они могут быть образованы параллельными цепями (N-концы целей направлены в одну и ту же сторону, (рис.ниже,а) и антипараллельными (N-концы направлены в разные стороны) (рис ниже,б).
Как правило, вторичная структура белковой молекулы содержит и α-, и β-участки, а также участки, не имеющие какой-либо правильной организации, называемые "беспорядочным" клубком. В этих участках полипептидная цепь сравнительно легко изгибается, меняя конформацию, в отличие от более жёстких структур α- и β-участков.
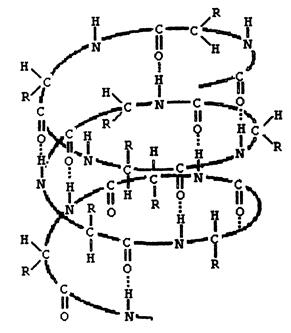
Рис. Схема α-спирали
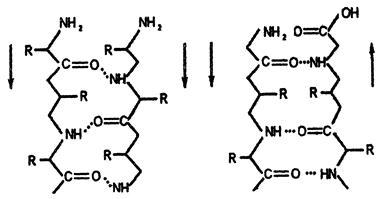
| а) | б) |
Рис. Схемы β-структур: а-параллельные цепи; б- антипараллельные цепи
