Робота № 6/1. Визначення константи швидкості оксидації водного розчину органічної речовини пероксидом водню
Мета роботи.Визначити порядок реакції методом Вант-Гоффа та константу швидкості реакції взаємодії водного розчину органічної речовини (фенолу, ацетальдегіду, бензолу, толуолу тощо) з пероксидом водню залежно від концентрації каталізатора.
Методика роботи.Більшість органічних речовин у водному розчині взаємодіють з пероксидом водню за умов, близьких до стандартних, за наявності каталізатора (Fe2+, Fe3+, Cu2+, Mn2+ і т. і.) та за 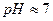 . При цьому відбувається оксидація органічної речовини і виділяється вода. Механізм таких реакцій є радикально-ланцюговим. Контроль за ходом реакції проводять за кількістю пероксиду водню в різні моменти часу.
. При цьому відбувається оксидація органічної речовини і виділяється вода. Механізм таких реакцій є радикально-ланцюговим. Контроль за ходом реакції проводять за кількістю пероксиду водню в різні моменти часу.
Порядок роботи. Для досліджень використовують реактор, в якому є три відгалуження (рис. 1). У відгалуження 1 уводять 5 мл розчину органічної речовини (заданої викладачем), в 2 – 5 мл пероксиду водню, в 3 - 0,5 мл 0,005 н розчину каталізатора, наприклад, Fe2+, Fe3+, Cu2+ та ін. Реактор закривають корком з шліфом і швидко перевертають дном догори. Після того, як усі розчини виллються, вміст пробірки треба добре перемішати і відмітити час. Це і є час початку реакції. Пробірку поставити у штатив і закрити корком (для запобігання випаровування органічної речовини).
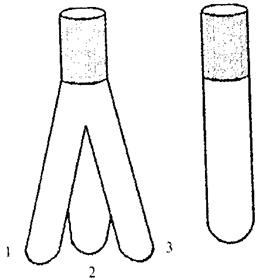 | Рис. 1. Реактор з трьома відгалуженнями та пробірка з шліфом, в яких розміщують реагенти |
Контроль за перебігом реакції здійснюють, визначаючи концентрацію пероксиду водню йодометричним методом. Для цього в колбу для титрування вливають 1 мл 1 н розчину йодиду калію, декілька крапель 10 н сірчаної кислоти для створення рН = 4-5, 1 краплю молібдату амонію (для прискорення реакції між KJ та H2O2) та 0,5 мл 0,1 н розчину NaF (для маскування Fe3+) або таку саму кількість ортофенантраліну (для маскування Fe2+).
У цю суміш доливають 1 мл проби, відібраної з досліджуваної суміші, і добре збовтують і записують час. Спостерігають, як забарвлюється розчин у буре (або жовте) забарвлення залежно від кількості виділеного йоду. Додають 1 краплю крохмалю і титрують 0,001 н розчином тіосульфату натрію до знебарвлення. Проби відбирають через 10 хв (чотири рази), через 15 хв (три рази), через 20 хв (два рази). Експериментальні дані записують у таблицю.
| Концентрація каталізатора: | |||||||
| № проби | Час | Час від початку реакції | V(Na2S2O3), мл | C(J2) | C(H2O2) | r | k |
Дослідження проводять протягом 2,5 - 3 год. Концентрацію йоду можна також визначати за допомогою фотоелектроколориметра, якщо відомий калібрувальний графік.За встановленими об'ємами Na2S2O3 обчислюють концентрацію пероксиду водню за рівнянням
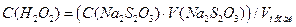 .
.
Одержані концентрації Н2О2 та вихідні концентрації вихідних речовин підставляють у рівняння для швидкості реакції 1-го порядку
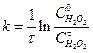 . (1)
. (1)
Якщо обчислені константи швидкості досліджуваної реакції будуть відрізнятись між собою, то для розрахунків k використовують рівняння, дійсне для реакцій 2-го порядку:
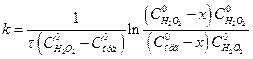 . (2)
. (2)
Знайти середнє арифметичне обчислених констант і відносну похибку кожної обчисленої константи швидкості.
