Энергия Гиббса. Направленность самопроизвольных химических реакций.
Энергия Гиббса - это величина, показ-ая изменение энергии в ходе хим.реакции и дающая ответ на принципиальную возможность хим. реакции. G=H-T*S, 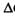 G=
G= 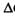 H-T*
H-T* 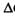 S
S
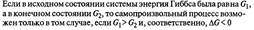
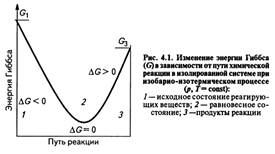

Полученное значение ΔG является критерием самопроизвольного течения реакции в прямом направлении, если ΔG < 0. Химическая реакция не может протекать самопроизвольно в прямом направлении, если энергия Гиббса системы возрастает, т.е. ΔG > 0. Если ΔG = 0, то реакция может протекать как в прямом, так и в обратном направлениях, т.е. реакция обратима.
Направление химических реакций зависит от их характера. Так, условие ΔG < 0 соблюдается при любой температуре для экзотермических реакций (ΔН < 0), у которых в ходе реакции возрастает число молей газообразных веществ, и, следовательно, энтропия (ΔS > 0). У таких реакций обе движущие силы (ΔН) и (ТΔS) направлены в сторону протекания прямой реакции и ΔG < 0 при любых температурах. Такие реакции являются необратимыми.
Наоборот, эндотермическая реакция (ΔН > 0), в результате которой уменьшается число молей газообразных веществ (ΔS < 0) не могут протекать самопроизвольно в прямом направлении при любой температуре, т.к. всегда ΔG > 0.
Если в результате экзотермической реакции (ΔН < 0) уменьшается число молей газообразных веществ и, соответственно, энтропия (ΔS < 0), то при невысокой температуре ΔН >TΔS и реакция возможна в прямом направлении (ΔG < 0). При высоких температурах ΔH < TΔS и прямая реакция самопроизвольно протекать не может (ΔG > 0), а обратная реакция возможна.
5.Термохимический закон Гесса. Тепловой эффект реакции.
Закон Гесса: тепловой эффект химической реакции не зависит от пути реакции, а зависит только от вида и начального и конечного состояния веществ.

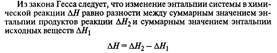
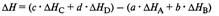
Тепловой эфффект реакции.


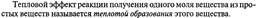

6.Скорость химической реакции. Закон действия масс.
Скорость химической реакции – это изменение концентрации исходного или образовавшегося в реакции вещества в единицу времени.

Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
V = k * [A] * [B], где [A] и [B] – концентрии реагирующих вещ-в А и В, k–коэфф.пропорциональности
V = k * [A]^a * [B]^b – основной постулат химической кинетики.
7.Зависимость скорости хим. реакции от температуры. Температурный коэффициент. Закон Вант-Гоффа. Теория активации.
Закон Вант-Гоффа: при повышении температуры на каждые 10 К скорость химической реакции возрастает в 2-4 раза.
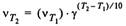

Уравнение Аррениуса:
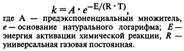

8.Явление катализа. Катализаторы, принцип действия. Теория переходного состояния и образования активированных комплексов. Биокатализаторы.
Эффективный способ повышения скорости реакции основан на применении катализаторов.
Катализаторами называются вещества, которые увеличивают скорость химической реакции, но сами при этом не изменяются. В живом организме реакции ускоряются ферментами. Процесс ускорения реакции с помощью катализаторов называется катализом. Вещества, замедляющие реакцию, называются ингибиторами, а процесс замедления реакции – ингибированием.
Катализ различают гомогенный и гетерогенный. При гомогенном катализе катализатор и реагирующие вещества находятся в одной фазе. При гетерогенном катализе катализатор и реагирующие вещества находятся в разных фазах.
Большинство биохимических превращений в организме животного являются каталитическими (ферментативными). По химической природе ферменты являются белками. Два фундаментальных свойства присущи биологическим катализаторам – специфичность катализа и способность ускорять реакцию. В живом организме имеется значтельное число различных ферментов.
9.Химическое равновесие с точки зрения термодинамики. Константа равновесия.
Состояние реагирующих веществ, при котором скорость прямой реакции равна скорости обратимой реакции, называется химическим равновесием.
Величина К, равна отношению констант скоростей прямой и обратной реакций, называется константой равновесия химической реакции. K = k1/k2.



10.Смещение химического равновесия. Принцип Ле Шателье.

11.Агрегатные состояния. Растворы: понятие, теория. Растворы насыщенные, ненасыщенные, пересыщенные.
Состояние одного и того же вещества, переходы между которыми сопровождаются скачкообразными изменениями объема и физических свойств вещества, называются агрегатными. Вещества могут существовать в твердом, жидком и газообразном состоянии. Переходы вещества из одного состояния в другое обусловлены изменением характера теплового движения частиц и их взаимодействия. Газом называют состояние вещества, из которого без понижения температуры не может быть получено твердое или жидкое состояния. Переход вещества из жидкого состояния в газообразное при температурах ниже критической называется парообразованием. Пар можно получить также сублимацией твердого вещества. Обратные процессы перехода пара в жидкое и твердое состояние называется конденсацией. В основе изучения газообразного состояния лежит понятие об идеальном газе. К состоянию идеального газа приближаются газы при низких давлениях, когда расстояния между молекулами настолько велики, что можно принебречь силами притяжения между ними. Уравнение Менделеева-Клапейрона pV=n*RT.
Перход твердого вещества в жидкое называется плавлением. Обратный процесс –кристаллизацией. Температура, при которой существуют три фазы вещества называется тройной точкой.

Понятие о растворах.Растворами называются многокомпонентные гомогенные системы, состоящие из растворителя, растворенного вещества и продуктов из взаимодействия. Растворы могут быть твердыми, жидкими и газовыми. Наибольший интерес в ветеринарной практике представляют жидкие, преимущественно водные, растворы.
Насыщенным называется раствор, находящийся в динамическом равновесии с избытком растворяемого твердого вещества. Дальнейшее растворение данного вещества при данных условиях в насыщенном растворе становится невозможным.
Ненасыщенным называется такой раствор, содержание растворенного вещества в котором ниже растворимости этого вещества при данных условиях. Ненасыщенные растворы стабильнее насыщенных, могут иметь различные концентрации, меньшие, чем растворимость.
Перенасыщенным называется раствор, в котором концентрация растворенного вещества выше, чем концентрация данного вещества в насыщенном растворе при тех же условиях.
ВОПРОС 12.
