Химическое равновесие. Принцип Ле Шателье
Многие химические реакции протекают таким образом, что исходные вещества целиком превращаются в продукты реакции или, как говорят, реакция идет до конца. Так, например, бертолетова соль при нагревании вся без остатка превращается в хлористый калий и кислород:
2КСlО3 = 2КСl + 3О2
Обратное получение бертолетовой соли из хлористого калия и кислорода оказывается невозможным. Такого рода реакции называются практически необратимыми, или односторонними.
Иной характер имеет реакция взаимодействия водорода с железной окалиной. Если пропускать водород над нагретой до высокой температуры железной окалиной, то последняя превращается в железо, а водород, соединяясь с кислородом окалины, образует воду:
Fe3O4 + 4Н2 = 3Fe + 4Н2О.
С другой стороны, пропуская при такой же температуре водяной пар на порошкообразным железом, можно получить железную окалину и водород. Эта реакция выражается тем же уравнением, что и предыдущая, если читать его справа налево:
3Fe + 4Н2О = Fe3O4 + 4Н2
Таким образом, при одной и той же температуре будут протекать две прямо противоположные реакции: из железной окалины и водорода будут получаться железо и водяной пар, а из последних – снова железная окалина и водород.
Процессы, которые при одних и тех же условиях могут идти как в ту, так и в другую сторону, называются обратимыми, или двусторонними.
Чтобы показать, что химический процесс обратим, в уравнении реакции заменяют знак равенства двумя стрелками, направленными в противоположные стороны:
Fe3O4 + 4Н2 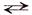 3Fe + 4Н2О
3Fe + 4Н2О
Реакцию, протекающую в направлении слева направо, принято называть прямой, противоположную реакцию – обратной.
Характерная особенность обратимых реакций заключается им, что они не доходят до конца, если продукты реакции не удаляются из сферы взаимодействия (например, при реакциях между газами в закрытом сосуде). Исходные вещества, если даже они были и взяты в эквивалентных количествах, никогда не расходуются полностью на образование продуктов реакции. Реакция идет лишь до известного предела и затем как бы останавливается.
Если реакция обратима, т.е. она может протекать как в прямом, так и обратном направлениях, то с течением времени скорость обратной реакции будет возрастать, когда скорости прямой и обратной реакции становятся одинаковыми, наступает состояние химического равновесия.
N2(г) + 3H2(г) 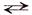 2NH3(г)
2NH3(г)
Установившееся между данными веществами химическое равновесие может сохраняться при неизменных условиях как угодно долго, но при изменении условий протекания реакции (температуры, давления, концентрации участвующих в реакции веществ), скорости прямого и обратного процессов изменяются неодинаково, и химическое равновесие нарушается.
Направление этого смещения подчиняется принципу Ле Шателье: при всяком внешнем воздействии на систему, находящуюся в состоянии химического равновесия, в ней протекают процессы, приводящие к уменьшению этого воздействия.
Так, повышение температуры приводит к смещению равновесия в направлении реакции, сопровождающейся поглощением теплоты, т. е. охлаждением системы; повышение давления вызывает смещение равновесия в направлении уменьшения общего числа молей газообразных веществ, т.е. в направлении, приводящем к понижению давления; удаление из системы одного из продуктов реакции ведет к смещению равновесия в сторону прямой реакции; уменьшение концентрации одного из исходных веществ приводит к сдвигу равновесия в направлении обратной реакции.
