Гальванические элементы. ЭДС гальванического элемента
Процессы превращения энергии химической реакции в электрическую лежат в основе работы химических источников тока (ХИТ). К ХИТ относятся гальванические элементы, аккумуляторы и топливные элементы. Гальваническим элементом называют устройство для прямого преобразования энергии химической реакции в электрическую, в котором реагенты (окислитель и восстановитель) входят непосредственно в состав элемента и расходуются в процессе его работы. После расхода реагентов элемент не может больше работать, то есть это – ХИТ одноразового действия. Гальванический элемент состоит их двух полуэлементов (окислительно-восстановительных систем), соединенных между собой металлическим проводником. Полуэлемент (иначе электрод) чаще всего представляет собой металл, помещенный в раствор, содержащий ионы, способные восстанавливаться или окисляться. Каждый электрод характеризуется определенным значением условного электродного потенциала Е, который в стандартных условиях определяется экспериментально относительно потенциала стандартного водородного электрода (СВЭ). СВЭ – это газовый электрод, который состоит из платины, контактирующей с газообразным водородом (Р 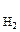 = 1 атм) и раствором, в котором активность ионов водорода а
= 1 атм) и раствором, в котором активность ионов водорода а 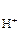 = 1 моль/дм3. Равновесие в водородном электроде отражается уравнением Н+ +
= 1 моль/дм3. Равновесие в водородном электроде отражается уравнением Н+ + 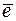 « ½ Н2. Абсолютное значение потенциала СВЭ неизвестно, но условно его считают равным нулю (Е
« ½ Н2. Абсолютное значение потенциала СВЭ неизвестно, но условно его считают равным нулю (Е 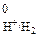 = 0 В). Потенциалы электродов рассчитывают по уравнению Нернста, которое при температуре 298 К имеет вид: 1) для металлических электродов I рода, то есть когда металл Ме погружен в раствор, содержащий ионы данного металла Меn+ :
= 0 В). Потенциалы электродов рассчитывают по уравнению Нернста, которое при температуре 298 К имеет вид: 1) для металлических электродов I рода, то есть когда металл Ме погружен в раствор, содержащий ионы данного металла Меn+ : 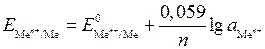 , где Е
, где Е 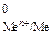 - стандартный электродный потенциал металла, В; а
- стандартный электродный потенциал металла, В; а 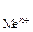 - активность ионов металла в растворе, моль/дм3. Значения стандартных электродных потенциалов практически для всех металлов определены экспериментально и содержатся в справочной литературе. В гальваническом элементе электрод, имеющий меньшее значение потенциала, называется анодом и обозначается знаком «–». На аноде идет окисление частиц восстановителя. Электрод, обладающий большим потенциалом, называется катодом и обозначается знаком «+». На катоде происходит восстановление частиц окислителя. Переход электронов с восстановителя на окислитель происходит по металлическому проводнику, который называют внешней цепью. ОВР, лежащая в основе работы гальванического элемента, называется токообразующей реакцией. Основной характеристикой работы элемента является его ЭДС DЕ, которая вычисляется как разность между потенциалами катода и анода: DЕ = Екатод – Еанод. Поскольку потенциал катода всегда больше потенциала анода, то из формулы следует, что в работающем гальваническом элементе DЕ > 0. Гальванические элементы принято записывать в виде схем, в которых одна вертикальная линия изображает границу раздела фаз (металл – раствор), а две вертикальные линии – границу между двумя растворами. На практике электрический контакт между растворами обеспечивается с помощью солевогомостика – U-образной трубки с раствором электролита.
- активность ионов металла в растворе, моль/дм3. Значения стандартных электродных потенциалов практически для всех металлов определены экспериментально и содержатся в справочной литературе. В гальваническом элементе электрод, имеющий меньшее значение потенциала, называется анодом и обозначается знаком «–». На аноде идет окисление частиц восстановителя. Электрод, обладающий большим потенциалом, называется катодом и обозначается знаком «+». На катоде происходит восстановление частиц окислителя. Переход электронов с восстановителя на окислитель происходит по металлическому проводнику, который называют внешней цепью. ОВР, лежащая в основе работы гальванического элемента, называется токообразующей реакцией. Основной характеристикой работы элемента является его ЭДС DЕ, которая вычисляется как разность между потенциалами катода и анода: DЕ = Екатод – Еанод. Поскольку потенциал катода всегда больше потенциала анода, то из формулы следует, что в работающем гальваническом элементе DЕ > 0. Гальванические элементы принято записывать в виде схем, в которых одна вертикальная линия изображает границу раздела фаз (металл – раствор), а две вертикальные линии – границу между двумя растворами. На практике электрический контакт между растворами обеспечивается с помощью солевогомостика – U-образной трубки с раствором электролита.
