Электролиз растворов солей на инертных электродах. Отчет по лабораторной работе № 3
Отчет по лабораторной работе № 3
«Электрохимические процессы и явления»
| Выполнил(а): Студент(ка) 1-го курса Группы №__________________ ФИО ______________________ ___________________________ ___________________________ | Проверил: Молочко А.П. |
Экспериментальная часть
Установить химическую активность металлов в водных растворах электролитов и их положение в электрохимическом ряду активностей
Ход опыта и результаты наблюдений опыта
Для выполнения эксперимента использовались металлы и растворы солей, представленные в табл.1.Так как исследуемые реакции являются окислительно-восстановительными и условием их протекания является неравенство 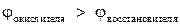 ,выпишем из табл.П. 2 пособия значенияφ0 для следующих сопряженных пар:
,выпишем из табл.П. 2 пособия значенияφ0 для следующих сопряженных пар:
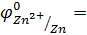 _______
_______
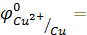 _______
_______
 ________
________
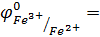 ______ φ0Fe3+/Fe0+ =
______ φ0Fe3+/Fe0+ =
Величинаφ0 металла указывает на меру восстановительной способности
атомов металлов и меру окислительной способности их ионов и, чем больше ее значение, тем ярче выражена окислительная способность. Из двух возможных реакций наиболее предпочтительна та , для которой неравенство φок > φвосст. выполняется в большей степени. Результаты теоретического прогноза омечены в табл.1.
Таблица 1.
| Металлы | CuSO4 | ZnSO4 | Al2(SO4)3 | FeCl3 (индикатор K3[Fe(CN)6]) |
| Zn | ||||
| Cu | ||||
| Al |
В ходе эксперимента проводили только те взаимодействия, которые возможны в соответствии с установленным условием их протекания.
Анализа результатов опыта
1. Объяснитепоявление синего окрашивания растворов в пробирках с FeCl3 и K3[Fe(CN)6], а также отсутствие признаков реакций Al с растворами солей CuSO4 и ZnSO4 Составьте уравнене реакции ионов Fe2+ c индикатором K3[Fe(CN)6] и образованием турнбулевой сини Fe3[Fe(CN)6]2, а также уравнения всех реакций в молекулярной и краткой ионной формах.
2. Какой из исследованных металлов самый активный и какой наименее? Расположите исследуемые металлы по убыванию их активности в водных растворах.
3.Укажите влияние пассивирующих (оксидных) слоев на поверхности активных металлов на характер протекания окислительно-восстановительных реакций.
______________________________________________________________________________________
2. Определение стандартной ЭДС химического гальванического элемента
Ход и данные опыта
Для выполнения данного опыта собрали изстандартных электродов 1-го рода медно-цинковый гальванический элемент, используя два химических стакана, емкостью 100мл, 1 М растворы солей ZnSO4 и CuSO4 , предварительно протравленные электроды из меди и цинка. Электролиты соединили электролитическим мостиком. Значение ЭДС определили с помощью цифрового милливольтметра.
Анализа результатов опыта
1. Составьте электрохимическую схему исследованного гальванического элемента в молекулярной и ионной формах, уравнения анодно-катодных процессов и суммарное уравнение токообразующей реакции. Запишите значение измеренной стандартной ЭДС.
________________________________ ________________________________________________________
2. Используя данные табл. П.2, рассчитайте значение стандартной ЭДС и сравните с экспериментальным. Рассчитайте изменение свободной энергии Гиббса (∆G0), максимально полезную работу (Ам) и константу равновесия (КР).
______________________________________________________________________________
3. Не проводя эксперимента, рассчитайте значения ЭДС исследуемого элемента при концентрациях растворов:
а) 0,001 М ZnSO4 и 1 М СuSO4; б)1 М ZnSO4 и 0,001 M СuSO4.
_______________________________________________________________________________________________
Сравните полученные значения ЭДС с величиной стандартной ЭДС и сделайте выводо влиянии концентраций потенциалопределяющих ионов на величины электродных потенциалов и значения ЭДС.
___________________________________________________________________________
4. Как изменятся процессы, если Zn- и Cu-электроды (оба) поместить в один и тот же раствор серной кислоты (H2SO4)? Как называется такой элемент? Ответ обосновать приведением электрохимической схемы элемента, уравнений анодно-катодных процессов и токообразующей реакции.
____________________________________________________________________________
5. Объясните, почему с течением времени в таком элементе значение ЭДС уменьшается? Какая поляризация имеет место в элементе Вольта? Какими способами можно уменьшить поляризацию и увеличить численное значение ЭДС?
____________________________________________________________________________________
6. Сделайте обобщающий вывод, от каких факторов зависит численное значение ЭДС химических гальванических элементов.
__________________________________________________________________________________
Электролиз растворов солей на инертных электродах
Ход и данные опыта
В опыте исследовали реакции, протекающие на графитовых электродах при прохождении постоянного тока через растворы солей CuSO4, KI, NaCl. При выполнении работы использовали:электролизер(U‑образная стеклянная трубка, закрепленная в штативе), графитовые электроды, выпрямитель тока Е‑24М или ИЭПП‑2 и 0,5 М растворы солей CuSO4, KI, NaCl.
Электролиз сульфата меди. Напряжение 20-25 В, в течение 2-3 мин. На катоде выделилась медь, на аноде наблюдали выделение пузырьков газа. В анодное пространство опустили полоску индикаторной бумаги и по цветовой эталонной шкале определили значение рН =
Электролиз иодида калия. Опыт проводили, используя предыдущую методику, наблюдая выделение пузырьков газа на катоде и окрашивание в светло-коричневый цвет анодного электролита. После добавления в катодное пространство фенолфталеина, в анодное – крахмала, растворы приобрели малиновый и синий цвета соответственно.
Электролиз хлорида натрия. Используя методику предыдущих опытов провели электролиз, наблюдая выделение пузырьков газа как на аноде, так и на катоде. После добавления в катодное пространство фенолфталеина, в анодное иодидокрахмального раствора ( КJ + крахмал) наблюдали малиновую окраску католита и синюю – анолита.
Анализа результатов опыта
1. Для каждого из трех опытов составьте схемы электролизных систем, уравнения первичных и вторичных анодно-катодных процессов и суммарные уравнения электролиза. Как и почему изменились при этом значения рН электролитов?
2. Почему на катодене выделяютсяметаллические калий и натрий, амедь выделяется? Как это связано с их активностью?
3.На примере электролиза раствора NaCl объясните влияние поляризации и перенапряжения на характер анодной реакции. Запишите уравнение качественной реакции на молекулярный хлор.
3. Сделайте обобщающий вывод об особенностях процессов электролиза на инертных электродах, указав для каждого из трех опытов основные факторы, определяющие природу продуктов электролиза.
______________________________________________________________________________.____________________________________________________________________
____
4._Ответы на контрольные вопросы.
1.
