В основе классификации ферментов - тип катализируемой реакции
Большое число ферментов уже в начале XX века поставило перед исследователями вопросы о номенклатуре и классификации ферментов. Отличительным признаком фермента в начале XX века стало окончание «аза», которое использовали, добавляя его вначале к названию субстрата (amylum -крахмал - амилаза), а затем к названию реакции (дегидрирование - дегидрогеназы). Созданная Международным союзом химиков и биохимиков Комиссия по Ферментам (КФ) разработала основные принципы классификации и номенклатуры ферментов, которые были приняты в 1961 г. В основу классификации был положен тип катализируемой ферментом реакции. Все ферменты по этому признаку были разделены на 6 классов, в каждом из которых есть несколько подклассов.
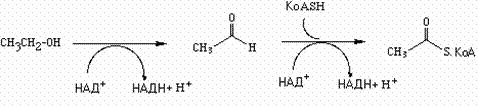
1.Оксидоредуктазы -ферменты, которые катализируют реакции восстановления или окисления. Например алкогольдегидрогеназа, фермент, который окисляет этиловый спирт в уксусный альдегид. Второй фермент, известный как альдегиддегидрогеназа затем преобразовывает уксусный альдегид в ацетил КoA. Оксидоредуктазы часто требуют участия кофакторов, выполняющих роль промежуточных акцепторов водорода в приводимом ниже примере это НАД+.
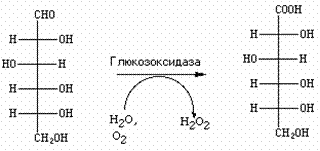 |
Оксидазы – разновидность оксидоредуктаз. Так называются ферменты, использующие кислород в качестве конечного акцептора водородов. Примером может служить глюкозоксидаза, которая окисляет глюкозу в глюконовую кислоту. Промежуточным акцептором водородов служит ФАД.
| Оксидоредуктазы (1.0.0.0.) 1.1.0.0. Действуют на СН-ОН группы доноров 1.1.1.0. НАД+ или НАДФ+ в качестве акцепторов 1.1.1.1. Алкогольдегидрогеназа 1.14.0.0. Действуют на парные доноры при включении в один из них кислорода 1.14.15.0. Один из доноров восстановленный железо-серный белок и включение одного атома кислорода 1.14.15.1. Цитохром Р-450 1.14.15.5. Кортикостерон 18-монооксигеназа |
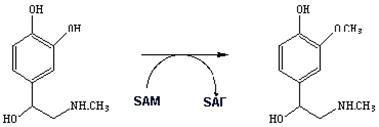
Трансферазы -ферменты, которые переносят функциональные группы от молекулы донора на молекулу акцептор. Примером могут служить метилтрансферазы, которые передает метиловую группу от S -аденозилметионина какому либо акцептору. Ниже показана реакция, катализируемая катехол-O-метилтрансферазой - ферментом, участвующим в метаболизме нейромедиаторов адреналина и норадреналина.
Еще один очень важный пример трансфераз – ферменты катализирующие перенос аминогруппы -трансаминазы.
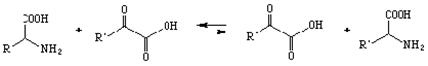
Трансаминазы используют аминокислоту в качестве донора аминогруппы, которую они переносят на - кетокислоту, превращая соответственно аминокислоту – донор в кетокислоту и кетокислоту – акцептор в аминокислоту. Это используется для взаимопревращения некоторых аминокислот и позволяет аминокислотам вступать в пути метаболизма углеводов или липидов.
Трансферазами, которые будут часто упоминаться в биохимии, являются киназы, катализирующие перенос фосфата от макроэргической молекулы АТФ на субстрат. Существует множество киназ, играющих важную роль в метаболизме клеток.
| Трансферазы (2.0.0.0.) 2.1.0.0.Переносят одноуглеродные группы 2.1.1.0. Метилтрансферазы 2.1.1.1. Никотинамид метилтрансфераза 2.1.1.45. Тимидилат синтаза 2.3.0.0. Ацилтрансферазы 2.3.1.6. холинацетил трансфераза |
3. Гидролазы -ферменты катализирующие биологические реакции гидролиза. Они разрывают ковалентные связи. присоединяя по месту разрыва элементы воды. Липазы, фосфатазы, ацетилхолинэстераза и протеазы - все это примеры гидролитических ферментов.
| Гидролазы (3.0.0.0.) 3.1.0.0.Действуют на эфирные связи 3.1.1.0.Гидролазы эфиров карбоновых кислот 3.1.1.17. Ацетилхолинэстераза 3.2.1.0. Гликозидгидролазы 3.2.1.1. амилаза 3.2.1.2. -амилаза 3.4.0.0. Действуют на пептидные связи 3.4.21.0.Сериновые протеазы 3.4.21.1.Химотрипсин 3.4.21.4. Трипсин 3.4.21.5. Тромбин |
4. Лиазы (десмолазы)–ферменты, которые катализируют распад C-C, C-O и C-N связями негидролитическим путем с образованием двойных связей. Примером может быть фермент ДОФА декарбоксилаза, которая является ключевым ферментом в синтезе биогенных аминов адреналина и норадреналина.
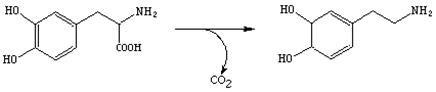
| Лиазы(4.0.0.0) 4.1.0.0.Углерод-углерод лиазы 4.1.1.0.Карбокси лиазы 4.1.1.1. Пируватдекарбоксилаза 4.2.0.0. Углерод-кислород-лиазы 4.2.1.0. Гидролиазы 4.2.1.11. Енолаза 4.2.1.12. Фосфоглюконатдегидраза |
5. Изомеразы - ферменты, которые катализируют внутримолекулярные перегруппировки. При этом происходит взаимопревращение оптических геометрических и позиционных изомеров. Эпимеразы и рацемазы - примеры ферментов этого класса.
| Изомеразы (5.0.0.0.) 5.1.0.0. Рацемазы и эпимеразы 5.1.1.0. Действуют на аминокислоты и их производные 5.1.1.1. Аланинрацемаза 5.3.0.0. Внутримолекулярные оксидоредуктазы. 5.3.1.0.Взаимопревращают альдозы и кетозы 5.3.1.9. Фосфоглюкоизомераза 5.3.1.20. Рибозоизомераза |
6. Лигазы катализируют образование C-O, C-S, C-N или C-C связей, используя энергию гидролиза АТФ. Фосфат может или не может ковалентно связываться с продуктом реакции.
| Лигазы (6.0.0.0) 6.1.0.0. Образуют С-О связи 6.1.1.0.Образуют молекулы аминоацил-тРНК и родственные им соединения. 6.1.1.1. Тирозил-тРНК синтаза 6.5.0.0. Образуют фосфоэфирные связи 6.5.1.1. ДНК-лигаза (АТФ -зависимая) 6.5.1.2. ДНК-лигаза (НАД+-зависимая) |
Комиссия по ферментам предложила и принципы номенклатуры ферментов. Рекомендуется использовать систематическую и рабочую номенклатуры. В основу систематической номенклатуры положен тот же принцип, что и для классификации – тип катализируемой реакции. На первый взгляд названия при этом становятся громоздкими, но зато из названия становится ясным, что делает фермент. Название состоит из двух частей: названия участников реакции ( в зависимости от класса это могут быть субстраты , промежуточные акцептоы) и типа катализируемой реакции с окончанием «аза».
Каждый фермент получает специфический кодовый номер-шифр фермента, отражающий его положение в классификации: первая цифра характеризует класс фермента, вторая –подкласс и третья подподкласс. Каждый подподкласс представляет собой список ферментов. Порядковый номер фермента в этом списке – четвертая цифра кода. На рис 1-1 показан шифр креатинфосфокиназы – КФ.2.7.3.2. Этот фермент катализирует реакцию фосфорилирования креатина. Систематическое название фермента АТФ: креатинфосфотрансфераза. Рабочее название этого фермента креатинкиназа или креатинфофокиназа
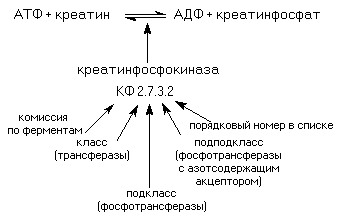 |
Шифр креатинфосфокиназы и место фермента в классификации ферментов
| Заведующий кафедрой биологической химии, д.м.н., проф. | Грицук А. И. | ___________ |
21.10.2006
Министерство здравоохранения Республики Беларусь
УО «Гомельский государственный медицинский университет»
Кафедра биологической химии
Обсуждено на заседании кафедры (МК или ЦУНМС)
Протокол № _________________200__года
ЛЕКЦИЯ
по биологической химии
наименование дисциплины
для студентов _2__ курса лечебного факультета
Тема Ферменты 5. Медицинская энзимология.
Время 90 мин.
Учебные и воспитательные цели:
Дать представление:
1. О медицинской энзимология: основные направления (энзимопатология, энзимодиагностика и энзимотерапия); применение ферментов в лабораторной диагностике; производственной практике и биотехнологии.
2. Об энзимопатиях: первичных и вторичных энзимопатии, степени клинического проявления; патогенезе энзимопатий – механизме развития вторичных метаболических блоков. Об энзимодиагностике: типы ферментов плазмы крови (клеточные, экскреторные, секреторные).
3. Об энзимотерапии: примеры; применении иммобилизованных ферментов, липосом, тенях эритроцитов, вирусных векторов.
ЛИТЕРАТУРА
1 Березов Т. Т., Коровкин Б. Ф. Биологическая химия. М.: Медицина, 1990. С. 213–220; 1998. С. 345–353.
2 Николаев А. Я. Биологическая химия. М.: Высшая школа, 1989. С. 199–221.
Дополнительная
3 Марри Р. и др. Биохимия человека. М.: Мир, 1993. Т. 1. С. 111–126.
4 Филиппович Ю. Б. Основы биохимии. М.: Высшая школа, 1993. С. 403–415.
5 Ленинджер А. Основы биохимии. М.: Мир, 1985. Т. 2. С. 477–507.
МАТЕРИАЛЬНОЕ ОБЕСПЕЧЕНИЕ
1. Мультимедийная презентация.
РАСЧЕТ УЧЕБНОГО ВРЕМЕНИ
| № п/п | Перечень учебных вопросов | Количество выделяемого времени в минутах |
| 1. | Медицинская энзимология. Основные направления (энзимопатология, энзимодиагностика и энзимотерапия). Применение ферментов в лабораторной диагностике, производственной практике и биотехнологии. | |
| 2. | Энзимопатии, классификации. Первичные и вторичные энзимопатии, степень клинического проявления. Патогенез энзимопатий – механизм развития вторичных метаболических блоков. Энзимодиагностика, цель, задачи. Типы ферментов плазмы крови (клеточные, экскреторные, секреторные). | |
| 3. | Энзимотерапия. Примеры. Иммобилизованные ферменты, липосомы, тени эритроцитов, вирусные векторы. Биотехнология. |
Всего 90 мин
