Обратимость реакции, катализируемой АТP-синтазой. Разобщение транспорта электронов и синтеза АТP; действие 2,4-динитрофенола
В настоящее время протонные АТР-синтазы выделены практически из всех типов сопрягающих мембран: митохондрий, хлоропластов, хроматофоров. АТР-синтазный комплекс (Н+-АТРаза) – обратимый фермент, обладающий как АТР-синтазной, так и АТРазной активностью. Синтез АТР осуществляется за счет протонного градиента ΔμН+, а гидролиз АТР приводит к тому, что протонная АТРаза сопряженно генерирует трансмембранную разность электрохимического потенциала Н+. В Н+-АТРазе происходят процессы по общей схеме:
АТР-синтаза
ΔμН+ ↔ АТР
АТРаза
АТР-синтазный комплекс (F0F1-АТРаза) состоит из растворимой АТР-синтазы (фактор F1) и мембранных компонентов (комплекс F0) (Рис.27.2).
Сопрягающий фактор АТР-синтазы (F1 для митохондрий и CF1 для хлоропластов) представляет собой полифункциональный белок, имеющий сложную четвертичную структуру. Он построен из трех типов крупных субъединиц – α, β, γ с молекулярной массой 30000-60000 Да и двух типов минорных субъединиц δ, ε с молекулярной массой 11000-20000 Да. Стехиометрия комплекса – 3α3βγδε. Разложение его на субъединицы ведет к потере ферментативной активности. «Шляпка» высотой 80Å и шириной 100Å грибовидного выроста АТР-синтазы соответствует фактору F1, частично погруженному в мембрану, в основании которого находится гидрофобный белок комплекса F0, который включает 3 типа полипептидов (a,b,c) с молекулярными массами от 6500 до 30000 кДа и обеспечивает связывание фактора F1 с мембраной и перенос протонов при работе фермента.

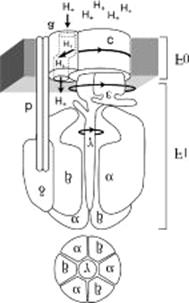
Рис.27.2. Общая топография АТР-синтазного комплекса
F1 – сопрягающий фактор, Fo – протонный канал (пояснения в тексте)
Комплекс F1 может поворачиваться вокруг оси, совпадающей по направлению с субъединицей γ. При повороте на 120º каждая из α и β-субъединиц перемещается на место другой такой же, а при повороте на 60º субъединицы меняются местами. В силу некоторой асимметричности вращение F1-комплекса переводит его β-субъединицы при каждом повороте в новое положение, где они попадают в другое микроокружение. Это и приводит к изменению состояния и конформационной перестройке активных центров при вращении F1. Каждый из трех активных центров в результате вращения F1-комплекса может поочередно находиться в одном из трех конформационных состояний, которые различаются по степени сродства молекул АТР, АDP и Pi к каталитическому центру. В состоянии 1 центр β-субъединицы открыт и в нем связываются молекулы АDP и Pн, которые сравнительно слабо удерживаются центром.
Вращение и конформационные перестройки комплекса F1 переводят этот центр в состояние 2, где непосредственно происходит синтез АТP. Здесь АDP и Pн прочно фиксируются в каталитическом центре, находясь в активной конфигурации, необходимой для образования ковалентной связи между фосфатными группами АDP и Pн. Поэтому на этой стадии не требуется притока энергии извне. В состоянии 2 в каталитическом центре самопроизвольно идет образование и разрыв ковалентной связи АDP-P, поскольку константа равновесия АТP↔АDP+Pi близка к единице.
На следующем этапе центр переходит в состояние 3, где за счет энергозависимой структурной перестройки происходит ослабление прочной связи молекулы АТP с центром и выход ее наружу. На освободившееся место из раствора приходят новые молекулы АDP и Pн. Перестройки носят кооперативный характер и затрагивают состояние всех трех каталитических центров β-субъединиц. Поскольку весь цикл включает 3 этапа, а в Н+-АТР-синтазе имеется 3 субъединицы, то после каждого структурного перехода в растворе появляется новая молекула АТР.
F0 формирует канал, по которому протоны поступают к активному центру АТРазы. Проводимость протонов носит специфический характер и подавляется антибиотиком олигомицином и ДЦКД (N,N′-дициклогексилкарбодиимид), ингибиторами Н+-АТР-синтазы. Особым образом организованный канал обеспечивает прохождение протона через всю мембрану из водной фазы в гидрофобную область мембраны, а затем из нее в воду по другую сторону от липопротеинового барьера. Основную роль в переносе играет ДЦКД-связывающий протеолипид. Предполагают, что он располагается поперек мембраны, так что полярная часть оказывается на внешней поверхности мембраны и служит входом в канал. Наиболее вероятным механизмом переноса протона представляется эстафетная передача по протон-донорным и протон-акцепторным группам аминокислот, включая остатки аргинина, тирозина, глутамина.
Комплекс F0 ‒ вращающийся ансамбль субъединиц с 9-12 остановками, позволяющими прерывать поток протонов. Временное связывание протонов может осуществляться остатком аспарагиновой кислоты на каждой субъединице. Каждый поворот γ-субъединицы внутри комплекса происходит в соответствии с тем, заполнено ли гидролитическое место АТР или АDP и Pн. Эти конформационные изменения (механические изменения структуры) обеспечивает перенос протонов водорода на каждый третий этап цикла. Связывание, гидролиз и освобождение АТP и ADP в F0-F1-АТP-синтазе зависит от величин и геометрии расположения заряда в активном состоянии. Пока еще не ясна природа и расположение заряженных групп, ответственных за непосредственное вращение молекулярного мотора Н-АТP-синтазы.
Механизм образования АТP
Согласно хемиосмотическому механизму захват энергии, выделяющейся в процессах электронного транспорта, осуществляется за счет создания трансмембранной разности ΔμН+, а перенос энергии к АТP-синтазе обеспечивается потоком протонов через ее протонный канал. Синтез АТР из АDP и Рi может происходить и в отсутствие переносчиков электронов. Для этого необходима лишь разность электрохимических потенциалов Н+ на мембране, в которой находится АТР-синтаза. Хемиосмотический принцип трансформации энергии не может объяснить непосредственного молекулярного механизма синтеза АТР.
Согласно одному из первых вариантов хемиосмотической гипотезы, образование АТР сопряжено с распадом высокоэнергетического предшественника: X~Y. Считали, что существуют некие компоненты (подвижные в липидах ионы) X и Y, находящиеся в мембране в виде XH и YOH, которые могут диссоциировать:
XH = X- + H+, YOH = YO- + H+
В митохондриальной мембране, у внешней стороны, происходит реакция конденсации:
2Н+ + Х- + YO- = Н2О + X~Y.
Эта реакция сильно сдвинута вправо за счет повышения трансмембранного ΔрН и движения анионов Х- и YO- к внешней поверхности под действием сил трансмембранного электрического поля. Однако эта гипотеза оказалась несостоятельной.
Согласно представлениям Митчелла, в активный центр АТР-синтазы нагнетаются протоны, которые непосредственно восстанавливают фосфорильный кислород неорганического фосфата в активном центре. Преодоление энергетического барьера элементарного акта синтеза АТР достигается за счет горячих протонов, которые разгоняются электрическим полем в протонном канале Н+-АТРазы. Такое представление оказалось термодинамически невозможным.
Другое предположение о существовании некоего аккумулятора, который накапливает протоны, движущиеся внутри АТР-синтазы до тех пор, пока не наберется энергия, достаточная для синтеза одной молекулы АТР, также не подтвердилось.
Проблему синтеза АТР в Н+-АТР-синтазе следует рассматривать, исходя из общих соображений о роли электрон-конформационных взаимодействий в механизмах ферментативного катализа. Как известно, элементарный акт катализа осуществляется в активном центре спонтанно, когда в нем достигается реакционноспособная конфигурация между реагирующими группами субстрата и фермента, расположенными на расстоянии порядка длин химических связей. На стадиях взаимодействия субстрата и фермента при образовании активной конфигурации и затем при отщеплении образовавшегося продукта в ферменте происходят конформационные изменения. Такие внешние факторы, как температура, ионная сила раствора, вязкость, могут влиять на эти релаксационные стадии. Однако непосредственный акт катализа в сформированной активной конфигурации уже не требует тепловой энергии активации.
Именно с этими представлениями согласуются результаты Бойера. Элементарное образование АТР может происходить в активном центре Н+-АТР-синтазы в условиях деэнергизации мембраны, когда ΔμН=0, и даже в активном центре изолированного фактора F1, находящегося в растворе. Однако валового синтеза АТР при этом не происходит. При энергизации мембраны за счет увеличения ΔμН процесс ускоряется в 1000 раз. Оказалось, что энергия ΔμН используется в основном для вытеснения прочно связанного АТР из каталитического центра. Энергия также затрачивается на связывание фосфата и АDP с ферментом.
