Препараты алифатических спиртов
Наркотический эффект, активность, токсичность зависят от Мr, от их агрегатного состояния, растворимости, от количества гидроксильных групп, от их положения, от наличия других функциональных групп.
Химическиесвойства.
1.Спирты – очень слабые кислоты, образуют алкоголяты с щелочными Ме.
2.Вступают в реакции этерификации с образованием сложных эфиров.
3.Окисляются до альдегидов, кислот и кетонов.
Spiritus aethylicus. Спирт этиловый: 95%, 90%, 70% и 40%
Получение:
1. Из крахмала:
2(C6H10O5)n + nH2O à nC12H22O11 – мальтоза
C12H22O11 + H2O à 2C6H12O6 – глюкоза
С6H12O6 à 2C2H5OH + CO2
2. Гидратацией этилена
CH2=CH2 + H2SO4 à C2H5OSO3H 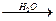 C2H5OH + H2SO4
C2H5OH + H2SO4
Описание: прозрачная бесцветная летучая жидкость с характерным запахом и жгучим вкусом. Легко воспламеняется и горит синеватым бездымным пламенем
Растворимость: во всех соотношениях с водой, эфиром, хлороформом, ацетоном, глицерином.
Подлинность:
1. Реакция образования сложного эфира:
C2H5OH + CH3COOH 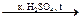 CH3COOC2H5 (запах) + H2O
CH3COOC2H5 (запах) + H2O
2. Йодоформная проба.
2NaOH + I2 à NaIO + NaI + H2O
С2H5OH + NaIO à CH3CHO + NaI + H2O
CH3CHO + 3NaIO à CI3CHO + 3NaOH
CI3CHO + NaOH à CHI3 (желтый крист.) +HCOONa
3.
3C2H5OH + K2Cr2O7 (желтый) + 4H2SO4 à 3CH3CHO (ябл) + Cr2(SO4)3 син-зел + K2SO4 + 7H2O
Примеси:
1. Определение примеси метанола:
5CH3OH + 2KMnO4 + 3H3PO4 à 5HCHO + K2HPO4 + 2MnHPO4 + 8H2O
 2. Определение примеси фурфурола:
2. Определение примеси фурфурола:
Количественноеопределение:
По плотности спирта, по температуре кипения водно-спиртовой смеси.
Применение: наружно в качестве антисептического и раздражающего средства для обтираний, компрессов. Растворитель для настоек, экстрактов.
Glycerinum. Глицерин. HOCH2-CH(OH)-CH2OH.
Описание: Прозрачная, бесцветная, сиропообразная жидкость без запаха сладкого вкуса, рН нейтральная.
Растворимость: Хорошо растворим в воде, спирте, практически не растворим в эфире и жирных маслах.
Получение:
1. Гидролизом сложных эфиров глицерина
2.
CH2=CH-CH3 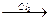 CH2=CH-CH2Cl
CH2=CH-CH2Cl 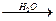
CH2=CH-CH2OH 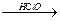 Cl-CH2-CHOH-CH2OH
Cl-CH2-CHOH-CH2OH 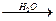 глицерин.
глицерин.
Подлинность:
1. Под действием серной кислоты выделяется неприятный запах акролеина.
глицерин 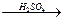 CH2=CH-CHO + 2H2O
CH2=CH-CHO + 2H2O
2.
Cu(OH)2 + 2глицерин à ярко-синий растворимый глицерат меди (II)
Количественноеопределение: по избытку уксусного ангидрида или NaOH на омыление образовавшегося эфира.
глицерин + 3 укс. ангидрид à уксусно-глицериновый эфир + 3 укс. к-ты
Применение: смягчающее действие при наружном применении, основа для приготовления мазей, мыл и др
Препараты простых эфиров
1. образование оксониевых солей с концентрированными минеральными кислотами:
R-O-R + HCl à [R-O+-R]Cl-
2. расщепляются в жестких условиях:
R-O-R + HI = R-I + ROH или R-O-R 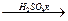 ROSO3H + ROH
ROSO3H + ROH
3. окисляются с образованием перекисных соединений:
R-O-R 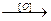 R-O-O-R
R-O-O-R
Титрование в неводных средах как метод количественного определения:
Достоинства титрования в неводных средах:
1. Можно определять органические и неорганические вещества, смеси различных компонентов, которые при титровании в водной среде не дают четкой КТТ (очень слабые кислоты и основания).
2. Можно титровать соединения, которые нерастворимы в воде, разлагаются водой, образуют эмульсии.
3. Можно использовать для бесцветных растворов.
4. КТТ можно определят индикатором, потенциометрически, кондуктометрически.
5. Можно титровать смеси без разделения.
6. Повышается точность титрования. Меньше поверхностное натяжение, меньше размер капли, меньше погрешность.
Недостатки:
1. Необходимо тщательно обезвоживать все растворы, титранты.
Титрование органических оснований и их солей в неводных средах:
Титрант: HClO4
Растворитель: CH3COOH ледяная.
Индикатор: кристаллический фиолетовый. Гексаметилпарарозанилинил хлорид. Три-(п-диметиламинофенил) карбоний хлорид. В щелочной среде фиолетовый, в кислой – желтый.
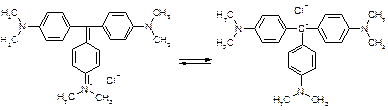
1. Растворение титранта. Образуется положительно заряженный ион "лиония" – ацетоний = ацелоний.
HClO4 + CH3COOH « ClO4- + CH3COOH2+
2. Растворение слабого основания в неводном растворителе. Образуется отрицательно заряженный ион "лиат" – ацетат.
R3N + CH3COOH « R3N+H + CH3COO-
3. Нейтрализация лиония и лиата. Суть процесса, единственная необратимая реакция.
CH3COO- + CH3COOH2+ à 2CH3COOH
4.
ClO4- + R3N+H à [R3N+H]ClO4-
Часто при титровании в ледяной уксусной кислоте добавляют уксусный ангидрид:
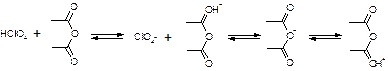
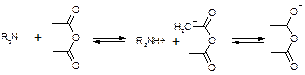
Роль уксусного ангидрида:
1. Связывает воду
2. Усиливает основные свойства слабых оснований (в большей мере, чем уксусная кислота). Смотри кофеин.
3. Ацилирует амино-, гидразино-группы, защищяя их при титровании. Смотри изониазид.
4. Способен связывать галогенид-ионы при титровании солей оснований в неводных средах.
Титрование солей:
R3N•HA + CH3COOH « R3NH+ + CH3COO- + HA
(R3N)2H2SO4 + CH3COOH « R3NH+ + CH3COO- + (R3NH+)HSO4-
Для солей серной, фосфорной, азотной кислот никаких особенностей больше нет. Они титруются по первой ступени, фактор равен единице.
А если мы имеем дело с солями галоген-водородных кислот, то возникают сложности. Выделяющаяся кислота может повлиять титрование.
HHal « H+ + Hal-
Cl- + CH3COOH « HCl + CH3COO-
И получится, что титрование идет не количественно. Поэтому надо связать все анионы галогенидов. Используют уксусный ангидрид:
R3N•HHal + (CH3CO)2O « R3NH+ + CH3COO- + CH3COCl
Препараты:
Aether medicinalis. Эфир медицинский. C2H5-O-C2H5
Описание: бесцветная прозрачная подвижная летучая легковоспламеняющаяся жидкость со своеобразным запахом.
Растворимость: растворим в воде, неограниченно в спирте, бензоле, эф. и ж. маслах
Получение:
C2H5OH + H2SO4 à C2H5OSO3H + H2O
C2H5OSO3H + C2H5OH à C2H5-O-C2H5 + H2SO4
Подлинность: Ткип и плотность
Примеси:
Пероксиды
C2H5-O-O-C2H5 + 2KI + H2O à I2 + C2H5-O-C2H5 + 2KOH
Альдегиды (темно-бурый осадок).
CH3CHO + 3KOH + K2HgI4 à комплекс ртути + CH3COOK + 4KI + 2H2O
Применение: растворитель для настоек, экстрактов, в фармацевтическом анализе.
Хранение: в хорошо укупоренной таре склянках оранжевого стекла без света вдали от огня. Закупоривают корковыми пробками с пергаментной подкладкой и заливают специальной цинк-желатиновой массой.
