Основы ферментативной кинетики.
Билет№3
СВОЙСТВА ФЕРМЕНТОВ.
Ферменты характеризуются очень высокой активностью, гораздо большей, чем обычные катализаторы. Например одна молекула каталазы способна за одну минуту расщепить 5000000 молекул перекиси водорода . Одна молекула карбангидразы за одну минуту катализирует взаимодействие 36000000 молей углекислого газа в реакции: СО2 + Н2О = Н2СО3. Молярная активность большинства ферментов оценивается превращением 1000 – 10000 молей. Но даже такие значения говорят о существенном ускорении реакции, если принять во внимание, что для большинства органических реакций в отсутствии катализатора даже при нагревании требуются минуты и часы. В отличие от неорганических катализаторв, ферменты обладают специфичностью. Это определяется соответствием конфигурации активного центра фермента и субстрата. Различают следующие виды специфичности:
1) Абсолютная – фермент действует только на одно определенное вещество. Например, L-аргиназа расщепляет только L-аргинин. Так действуют большинство дегидрогеназ (ЛДГ, и т. д.).
2) Абсолютная групповая – фермент вызывает один и тот же каталитический эффект у группы соединений (как правило, у соединений одного гомологического ряда). Например, алкогольдегидрогеназа – окисляет этиловый, пропиловый, бутиловый и т. д. спирты.
3) Относительная групповая – идет катализ разных классов органических веществ. Например, трипсин прояввляет пептидазную активность в белках и эстеразную в сложных эфирах.
4) Стереохимическая – расщипляется только определенная форма изомеров (D-L, альфа–бета, цис – транс и т. д.). Активность ферментов в значительной мере зависит от рН. При этом для работы каждого фермента характерен свой оптимум рН. Например,пепсин наиболее активен при рН = 1 – 2, амилаза – при рН = 7; аминокислотоксидаза – при рН = 10 – 11. Чувствительность к изменеию рН объясняется следующим образом: при изменении реакции среды изменяется тип ионизации функциональных групп ферментов, в результате этого образуются новые ионные связи, или разрушаются старые, и , как следствие, изменяется конформация молекулы белка-фермента. Это в свою очередь приводит к изменению физико-химических свойств и биологической активности. В клинике при такой ситуации вводятся буферные растворы, которые способствуют нормализации рН, соответственно восстанавливается и активность фермента. Например, при уменьшении кислотности желудочного сока вводится раствор соляной кислоты, что приводит к восстановлению активности пепсина.
Ферменты термолабильнны. При увеличении температуры на каждые 10 градусов скорость реакции увеличивается в 2 – 4 раза. Оптимальная температура для работы фермента 37 – 40 градусов по Цельсию. При дальнейшем повышении температуры ферменты, являясь белками, подвергаются денатурации, теряя ферментативную активность. В этом случае денатурация будет необратима. При снижении температуры ферменты тоже теряют свою активность, но это явление обратимое. Это свойство используется в криохирургии, чтобы в тканях замедлить все процессы, чтобы запасов кислорода и энергии в тканях хватило на более длительное время; для хранения ферментов.
Ферменты фотолабильны. Они очень чувствительны к ультрафиолетовым лучам, так как ферменты – это белки и они при действии ультрафиолета денатурируют (это лежит в основе ультрафиолетового облучения в медицине).
ОСНОВЫ ФЕРМЕНТАТИВНОЙ КИНЕТИКИ.
] 2.Распад ТАГ
ЖК преимущественно существует в составе сложных эфиров, главным образом в виде ацилглицеринов и фосфоацилглицеринов. Основная эндогенная форма хранения ЖК - это ацилглицерины (они составляют жировое депо). Фосфоглицерины в основном находятся в составе биологических мембран. Клетки разрушают липиды обоих классов в процессе, катализируемом двумя специализированными группами ферментов - липидами и фосфолипидами. Этот процесс называется липолизом. Обе группы ферментов находятся в цитоплазме. Действие этих ферментов сводится к гидролизу с образованием ЖК. Если этот процесс протекает в клетках жировой ткани, то образовавшиеся ЖК поступают в систему кровообращения и далее поглощаются большинством тканей (за исключением мозговой ткани и эритроцитов), где они либо эстерифицируются в ходе анаболических процессов, либо подвергаются дальнейшему расщеплению до СО2 и Н2О с образованием энергии. Процессы липолиза имеют мощную гормональную регуляцию. Тормозит липолиз инсулин. Он способствует увеличению поступления глюкозы в клетки жировой ткани и, повышая активность соответствующих ферментов, способствует усилению синтеза ЖК и ТАГ. Основное же действие инсулина состоит в ингибировании липазы. Жировая ткань более чувствительна к действию инсулина, чем многие другие ткани. Ряд гормонов, напротив, стимулирует липолиз. Это адреналин, норадриналин, глюкогон, АКТГ, меланоцитстимулирующий гормон, тиреотропный гормон, гормон роста, вазопрессин. Многие из этих гормонов активируют липазу. Для нормального протекания липолиза необходимо присутствие глюкокортикоидов и гормонов щитовидной железы. Сами по себе эти гормоны не оказывают влияния на липолиз, а действуют как факторы, стимулирующие действие других гормонов. Катехолоамины, например, стимулируют активность аденилатциклазы, повышая образование из АТФ → ц. АМФ. Даже ц. АМФ активирует протеникиназу, которая в свою очередь, активирует, фосфорилируя липазу. Следовательно, чем > образуется ц. АМФ, тем интенсивнее идут процессы липолиза. Распад ц. АМФ предотвращается метилксантинами (кофеин, теофиллин), которые ингибируют ферменты, катализирующие переход ц. АМФ в 5 - АМФ. Таким образом, при липолизе образуются ЖК и глицерин, которые подвергаются дальнейшим процессам катаболизма. Распад глицерина: (протекает в цитоплазме). Глицерин вначале, как правило, фосфорилируется, т.е. образуется его активная форма, затем происходит дальнейшее окисление:
Распад глицерина:
СН2ОН СН2ОН СН2ОН

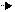


 АТФ АДФ НАД НАДН
АТФ АДФ НАД НАДН
-Н2О (ФАД) (ФАДН2)


 СНОН СН - ОН С = О
СНОН СН - ОН С = О


 глицерокинада глицерофосфат Дr
глицерокинада глицерофосфат Дr
СН2ОН СН2ОРО3Н2 СН2ОРО3Н2
Глицерин Глицерофосфат Фосфодиокстацион
Далее фосфодиоксиацетон окисляется также, как и в процессах гликолиза. → ПВК → ацетил КоА → ц. Креб
3.МЫШЕЧНАЯ ТКАНЬ.Мышцы – главный биохимический преобразователь химической энергии в кинетическую (механическую). На мышечную ткань при рождении приходится около 25%, в среднем возрасте более 40%, у пожилых людей около 30%. Мышечная ткань занимает первое место по объему среди других тканей человека. Существует три типа мышц: скелетные и сердечные (при микроскопическом исследовании обнаруживает поперечную исчерченность), в гладких мышцах такая исчерченность отсутствует. Скелетные мышцы находятся под волевым нервным контролем, сердечная и гладкая мышцы функционируют непроизвольно. Мышца состоит на 75% из воды и около 20% белка.Структура мышц.
Поперечно-полосатая мышца состоит из многоядерных клеток – мышечных волокон – окруженных электровозбудимой мембраной – сарколеммой. Клетка может быть вытянута во всю длинну мышцы, ее толщина может достигать 100 мкм. При микроскопическом исследовании в клетке обнаруживается пучок, состоящий из множества параллельно расположенных монофибрилл, диаметр каждой из которых составляет около 1 мкм. Они погружены во внутриклеточную жидкость, которая называется саркоплазма. Эта жидкость содержит, гликоген, макроэрги (АТФ и креатинфосфат) и ферменты гликолиза.
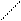
Функциональная единица мышцы – саркомер. Саркомер расположен между двумя соседними Z –нитями.






Диск I Диск А и






















 б
б



 р
р






 и
и



 л
л

 л
л


 а
а
 Зона Н
Зона Н




 толстая
толстая


 нить
нить










 тонкая
тонкая



 нить
нить
саркомер
Саркомеры следуют друг за другом вдоль оси фибриллы, повторяясь через каждые 1500 – 2300 нм. При электронном микроскопировании в миофибриллах выявлятся чередование темных и светлых участков (дисков). Темные диски отличаются двойным лучепреломлением и называются А – дисками (анизотропнми). Светлые диски не обладают двойным лучепреломлением и называются I – дисками (изотропными). Центральная часть диска А имеет менее плотный (то есть более светлый) участок, который называется зона Н. Диск I делит пополам очень плотная другая линия – Z линия. А – диски и I – диски всех мышечных волокон совпадают, что и придает мышце поперечно-полосатую исчерченность. Каждая миофибрилла состоит из двух типов продольных филаментов (нитей). Первый тип – «толстые» филаменты (нити) состоят главным образом из белка миозина. В состав филамента входит примерно 400 молекул миозина. Миозин по массе составляет примерно 55% мышечного белка (М = 460000). В миозине различают фибриллярную часть, состоящую из двух переплетенных спиралей, каждая из которых имеет на одном конце глобулярную «головку». Миозин – гексамер, он имеет пару тяжелых цепей (М = 200000) и две пары легких цепей (М = 15000 - 27000). Толщина толстых нитей составляет около 16 нм в диаметре. Они располагаются на диске А. Второй тип филаментов – «тонкие» нити занимают I – диск и распространяются на диск А, но не достигают его Н – зоны. Диаметр тонких нитей = 6 нм. Каждый толстый филамент окружен шестью тонкими, а каждый тонкий филамент – тремя толстыми филаментами. Тонкие филаметы образованы тремя белками:
1) Актин – составляет около 25% массы мышечного белка (М = 43000). Это глобулярный белок (G - актин). В присутствии ионов магния подвергается полимеризации с образованием довольно спирального филамента (F - актин). Полный виток спирали содержит 13 –14 молекул актина, толщина 6 – 7 нм.
2) Тропомиозин – представляет собой вытянутую в виде тяжа молекулу, состоящую из двух цепей (альфа и бета) и примыкающую к F – актину.
3) Тропонин – сферическая молекула, состоящая из трех неодинаковых субъединиц.
а) тропомиозин связывающая (тропонин Т) – из-за избытка положительных зарядов этот тропонин способен связывать F-актин и тропомиозин в единый комплекс.
б) Ингибиторная (тропонин-I) – ингибирует взаимодействие между F-актином и миозином.
в) Кальций-связывающая – способна связывать 4 молекулы ионов кальция (по структуре и функции аналогичен кальмодулину).
Сокращение мышц – это результат сокращения составляющих ее мышечных клеток (волокон). Сокращение мышечного волокна – следствие укорочения его каждого саркомера, которое происходит в результате взаимодействия толстых и тонких филаментов, которые при этом скользят друг относительно друга. Длина филаментов при этом не меняется, но Н-зона и I-диски укорачиваются, уменьшается расстояние между Z-линиями, то есть происходит укорочение саркомера.
Мышечные сокращение состоит из циклов присоединения и отсоединения глобулярной «головки» миозина от нити F-актина. Присоединение сопровождается изменением актин-миозинового взаимодействия, так что актиновые и миозиновые филаменты скользят относительно друг друга. Энергия для этого скольжения поставляется за счет гидролиза АТФ. Цикл состоит из 5 стадий:
1) Миозиновая головка сама по себе может гидролизовать АТФ до АДФ и фосфорной кислоты, но не обеспечивает освобождение продуктов гидролиза.
2) Миозиновая головка, содержащая АДФ и фосфорную кислоту может свободно вращаться под большими углами, что обеспечивает ее связь с F- актином.
3) Это взаимодействие обеспечивает высвобождение АДФ и фосфорной кислоты из актин-миозинового комплекса, (активируется миозиновая АТФ-аза).
4) Новая молекула АТФ связывается с комплексом миозин – F-актин.
5) Комплекс АТФ – миозин обладает малым сродством к актину и поэтому присходит отделение АТФ-головки миозина от актина. Это, по сути, и есть расслабление, а затем все стадии повторяются вновь. Таким образом, АТФ отсоединяет миозиновую головку от тонкой нити и является движущей силой сокращения. КПД такого сокращения равно 50% (КПД двигателя внутреннего сгорания 20%).

Актин АТФ-миозин Н2О
 | |||
 | |||


