Лекція 3. Ненасичені вуглеводні
План
1. Алкени. Гомологічний ряд, номенклатура, ізомерія.
2. Способи добування алкенів.
3. Фізичні та хімічні властивості алкенів.
4. Загальна характеристика та класифікація дієнів
5. Способи добування дієнових вуглеводнів
6. Фізичні та хімічні властивості.
7. Алкіни. Гомологічний ряд, номенклатура, ізомерія.
8. Способи добування алкінів.
9. Фізичні та хімічні властивості алкінів.
10. Поширення в природі ненасичених вуглеводнів та їх застосування в різних галузях сільського господарства.
1. Алкени (етиленові вуглеводні, етени або олефіни) – ненасичені вуглеводні з одним подвійним зв’язком і загальною формулою СnН2n.
В кожного ненасиченого атома Карбону гібридизується одна s- та дві р- орбіталі, одна р- орбіталь залишається вільною, тобто для алкенів характерна sp2-гібридизація. Валентний кут становить 120°. При цьому утворюються оптимальні умови для перекриття електронних орбіталей. Три такі орбіталі атома Карбону утворюють три σ-зв’язки (два С–Н та один С–С). р-електрони, що залишились у незмінному вигляді, утворюють ще один зв'язок між атомами Карбону. Орбіталь кожного такого електрона має вигляд об’ємної вісімки і розташована перпендикулярно до площини розміщення σ-зв’язків. Отже молекула етилену має 5 σ-зв’язків розташованих в одній площині і один π-зв'язок розташований перпендикулярно до площини σ-зв’язків. Всі атоми у молекулі утворюють між собою кут 120°.
| σ-зв’язок |
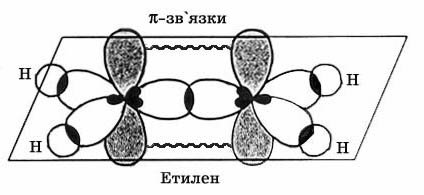
Найпростішим членом ряду є етилен CH2=CH2, від назви якого походить назва всього ряду. Алкени утворюють гомологічний ряд, який можна записати виходячи з гомологічного ряду алканів віднявши два атоми Гідрогену. Гомологічний ряд алкенів: С2Н4, С3Н6, С4Н8, С5Н10, і т.д.
Номенклатура. За раціональною номенклатурою алкени розглядаються як похідні етилену, в яких атоми гідрогену заміщені радикалами. Так, вуглеводень СН3=СН–СН3 має назву метилетилен, вуглеводень СН3–СН=СН–СН2–СН3 метилетилетилен і т.д.
За номенклатурою IUPAC назва алкенів походить від назви відповідних насичених вуглеводнів, що має найдовший карбоновий ланцюг, причому cуфікс -ан замінюється суфіксом -ен (-єн) і цифрою вказується номер того атома Карбону, який зв’язаний з наступним Карбоновим атомом – подвійним зв’язком (положення кратного зв’язку). Нумерація ланцюга починається з того боку, до якого ближче розміщений цей зв'язок, наприклад:
 |  |
| бутен-1 | 2-метилпропен-1 |
Назви одновалентних залишків алкенів мають закінчення –енил, наприклад:
СН3–СН2–СН=СН– СН3–СН=С–СН3
1-Бутенил-1 2-бутенил-2
Деякі типові групи мають тривіальні назви, наприклад:
СН2=СН– СН2=СН–СН2– СН2=С–СН3
Вініл Аліл Ізопропеніл
Ізомерія. Ізомерія алкенів залежить від: 1) ізомерії будови ланцюга карбонових атомів: 2) положення подвійного зв’язку в ланцюгу. Існує ще й третя причина ізомерії алкенів: різне розташування атомів і атомних груп в просторі, тобто так звана просторова ізомерія, або цис-транс-ізомерія.
Структурна ізомерія (положення кратного звязку та ізомерія карбонового скелету) у алкенів починається з бутену С4Н10.
У ряді алкенів ми зустрічаємось зі стереоізомерією особливого роду – так званою цис- і транс-ізомерією, або геометричною ізомерією. Виходячи із природи p-зв’язку, згідно з якою всі атоми етену лежать в одній площині і p-зв’язок утворюється взаємодією електронних шарів особливої форми, які мають вигляд об’ємної вісімки, що виключає можливість вільного обертання навколо зв’язку С=С. Це приводить до просторової фіксації прилягаючих до цих карбонових атомів радикалів, які можуть розміщуватися по один або по різні боки від площини симетрії подвійного зв’язку, чим і обумовлена цис- і транс-ізомерія.
Як приклад, можна навести цис- і транс-ізомери бутену-2, формули яких зображено нижче:
 |  |
| (Z)-2-бутен Цис-ізомер | (Е) -2-бутен транс-ізомер |
Ізомери, у яких однакові атоми (або атомні групи) розміщені по один бік від площини подвійного зв’язку, називаються цис-ізомерами; ізомери, у яких однакові атоми (або атомні групи) розміщені по різні боки площини подвійного зв’язку, називаються транс-ізомерами.
2. Способи добування алкенів.
1. Добування з галогенопохідних. Алкени добувають відщепленням галогеноводнів від галогенопохідних насичених вуглеводнів. Для цього, як правило, застосовують спиртові розчини лугів:
 .
.
У випадках, коли відщеплення Гідрогену можливе у двох положеннях, то будуть утворюватись обидва ізомери, але в більшості випадків буде відбуватись відщеплення там, де буде утворюватись більш стійкий продукт реакції – алкен з найбільшою кількістю замісників біля подвійного зв’язку (правило Зайцева).
→CH3–CH=CH–CH3 (80%)
СН3–СН2–СН–СН3 +КОН, спирт →
Сl → CH3–CH2–CH=CH2 (20%)
Реакційна здатність галогеналканів у реакціях дегідрогалогенування зменшується в ряду: третинний > вторинний > первинний.
2. Дегідратація спиртів. Алкени можна добути відщепленням елементів води від насичених спиртів:
 ,
,
 ,
,
 .
.
У заводських умовах для добування алкенів пару спирту при температурі 350 – 500°С пропускають над каталізатором (Al2O3 та ін.). У лабораторних умовах спирти нагрівають з водовіднімаючими речовинами, наприклад з сульфатною (60%) або фосфатною кислотою, хлористим цинком та ін. При дії сульфатної кислоти на спирти спочатку утворюються складні ефіри, наприклад з етилового спирту утворюється етилсульфатна кислота:
 .
.
Етилсульфатна кислота при нагріванні до 160 – 170°С розкладається на ненасичений вуглеводень і сульфатну кислоту:
 .
.
Легкість дегідратації спиртів змінюється в такій послідовності: третинний > вторинний > первинний.
3. Дегалогенування віцинальних дигалогенопохідних алканів. При нагріванні з подрібненим цинком, або магнієм у відповідному розчиннику, наприклад у спирті, останні легко перетворюються на алкени:
 .
.
4. Часткове гідрування ацетиленових вуглеводів.
Для синтезу чистих цис-алкенів відновлюють паладієм, а транс-алкенів без домішок інших ізомерів алкени відновлюють натрієм:
 .
.
5. Дегідрування алканів.
 .
.
6. Дія високих температур. Найважливішими промисловими способами одержання алкенів є: піроліз газоподібних алканів (етан, пропан або їх суміш) та каталітичне дегідрування бутанів.
Піроліз газоподібних алканів, найчастіше суміші етану та пропану, провадять при температурі близько 800°С. При цій температурі етан дегідрується, а пропан зазнає і розщеплення і дегідрування:
 ,
,
 ,
,
 .
.
Каталітичне дегідрування n-бутану в бутилени провадять при звичайному тиску і при температурі 550 – 600°C за наявності каталізатора (суміш оксидів хрому й алюмінію з КОН):
С4Н10 ® С4Н8 + Н2.
Важливим джерелом одержання алкенів є також крекінг газу та піролізу нафтових фракцій і мазуту.
3. Фізичні властивості. Нижчі представники алкенів є, при звичайній температурі, газами: починаючи з алкенів (С5Н10) – рідини, вищі гомологи, починаючи з С19Н38 – тверді тіла. Розчинність нижчих гомологів у воді невелика й зменшується зі зростанням молекулярної маси, добре розчинні в органічних розчинниках. Етилен і пропілен горять кіптявим полум’ям. Точки кипіння і молекулярні маси алкенів вищі, ніж у насичених вуглеводнів з таким же карбоновим скелетом. Серед структурних ізомерів розгалудженість знижує температуру кипіння. Температура кипіння транс-ізомерів нижча, ніж цис-ізомерів, а плавлення – навпаки.
Хімічні властивості.Визначаються наявністю подвійного зв’язку. Карбонові атоми в молекулі етилену перебувають у стані sp2- гібридизації, тобто в гібридизації беруть участь одна s- і дві p-орбіталі.
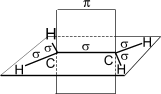 | 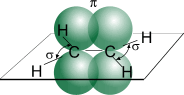 |
| Рис. 1. Схематичне зображення будови молекули етилену. |
p-Зв'язок менш міцний, ніж s-зв'язок, тому що p-орбіталі з паралельними осями перекриваються значно менше, ніж при утворенні тими ж p-орбіталями й s-орбіталями s- зв'язку (перекривання здійснюється по осі орбіталей). У зв'язку із цим, p-зв'язок легко розривається й переходить у два нові s-зв'язки за допомогою приєднання по місцю подвійного зв'язку двох атомів або груп атомів реагуючих речовин. Іншими словами, для алкенів найбільш типовими є реакції приєднання. У реакціях приєднання подвійний зв'язок виступає як донор електронів, тому для алкенів характерні реакції електрофільного приєднання.
1. Приєднання гідрогену (гідрування). Алкени в присутності металічних каталізаторів (платини, паладію, нікелю, міді) приєднують гідроген, утворюючи насичені вуглеводні. Так, у присутності подрібненої платини або паладію алкени вже при звичайній температурі приєднують гідроген:
 .
.
За наявності подрібненого нікелю ця реакція проходить при температурі 150 – 300°C (реакція Сабатьє).
Каталізатори застосовують у дрібноподрібненому стані. Іноді каталізатори наносять на носій – азбест, активоване вугілля, кізельгур, пемзу, каолін, кальцій карбонат.
2. Приєднання галогенів. Алкени дуже легко приєднують галогени, особливо хлор і бром:
 ,
,
 .
.
Реакцією приєднання брому (бромної води) користуються для відкриття в молекулі подвійних зв’язків. Ознакою наявності подвійного або потрійного зв’язку є знебарвлення бромної води.
Реакцію приєднання брому до алкенів використовують також для кількісного визначення подвійного зв’язку, при цьому титрування провадять до зникнення забарвлення брому. Як розчинники можна застосувати хлороформ, чотирихлористий вуглець, сірковуглець, оцтову (льодяну) кислоту та ефіри.
3. Приєднання галогеноводнів. Алкени легко приєднують за місцем подвійного зв’язку галогеноводні, причому найбільш легко приєднують HJ, найбільш важко – НСl
 .
.
При цьому атом гідрогену приєднується до найбільш гідрогенізованого карбонового атома, тобто карбону, зв’язаного з найбільшою кількістю атомів гідрогену. Ця закономірність була встановлена В.В. Марковниковим і тому називається правилом Марковникова.
У деяких випадках приєднання відбувається в зворотному напрямку. Так, Караш встановив, що за наявності оксигену повітря, перекисних сполук або інших джерел вільних радикалів, приєднання HBr до несиметрично побудованих гомологів етилену відбувається всупереч цьому правилу і гідроген приєднується до найменш гідрогенізованих атомів карбону (пероксидний ефект Караша):
 .
.
4. Приєднання елементів води (гідратація алкенів). Приєднання елементів води до алкенів призводить до утворення вторинних або третинних спиртів, і лише етилен утворює первинний (етиловий) спирт:
 ,
,
 ,
,
 .
.
Приєднання елементів води відбувається за правилом Mapковникова: гідроген приєднується до найбільш гідрогенізованого атома карбону, а гідроксил – до найменш гідрогенізованого.
У заводській практиці приєднання елементів води до алкенів здійснюють шляхом прямої і непрямої гідратації.
Метод прямої гідратації полягає в безпосередній взаємодії алкену з водою або водяною парою за наявності каталізаторів (фосфорна кислота та її солі, сульфатна кислота, оксид алюмінію та ін.).
Встановлено, що гідратація ізоалкенів відбувається легше, ніж алкенів нормальної будови. Чим коротший карбоновий ланцюг вуглеводню, тим важче відбувається гідратація; найважче гідратується етилен.
При одержанні спиртів за методом непрямої гідратації спочатку відбувається приєднання до алкенів сульфатної кислоти з утворенням суміші кислих та середніх сульфатнокислих ефірів (алкілсульфатних кислот та діалкілсульфатів). Швидкість процесу залежить від будови вуглеводню, умов проходження (тиск, температура) і концентрації сульфатної кислоти.
Швидкість взаємодії алкенів з сульфатною кислотою зростає при переході до вищих гомологів – до С6, а далі (починаючи з С7) зменшується. Ізоалкени взаємодіють, як правило, значно швидше, ніж олефіни нормальної будови.
5. Приєднання гіпохлоритної кислоти. Алкени легко приєднують за місцем подвійного зв’язку гіпохлоритну кислоту; при цьому до одного Карбонового атома (більш гідрогенізованого) приєднується хлор до іншого – гідроксил:
 .
.
6. Приєднання алканів (алкілування). Алкени приєднують алкани, наприклад, при взаємодії n-бутилену з ізобутаном утворюється 2, 2, 3-триметилпентан:
 .
.
Процес алкілування може відбуватися як за наявності каталізаторів (H2SO4, HF, АlСl3 та ін.), так і без них.
Каталітичний процес провадять при нормальній температурі і під тиском, близьким до атмосферного. В присутності 96 – 97%-ної сульфатної кислоти алкани, які мають третинний Карбоновий атом, легко реагують з алкенами (крім етилену). Більш активним каталізатором є хлористий алюміній у присутності якого можна алкілувати етиленом ізоалкани та алкани нормальної будови. За відсутності каталізаторів алкілування насичених вуглеводнів проводять під тиском 300 – 350 ат. і при температурі близько 500°С.
Реакція алкілування алканів алкенами застосовується в техніці головним чином для одержання компонентів моторного палива з високими антидетонаційними властивостями.
7. Окиснення алкенів.
А) реакція Вагнера. На відміну від алканів алкени легко піддаються окисненню. При обережному окисненні їх водним розчином КМnО4 в лужному середовищі (на холоді) за місцем подвійного зв’язку відбувається приєднання атома Оксигену і молекули води і утворюються двоатомні спирти, або гліколі, наприклад:
 .
.
Ця реакція є якісною реакцією на алкени. Фіолетове забарвлення розчину КМnO4 знебарвлюється (МnO4- переходить в Мn+2), а потім буріє від виділення осаду – марганець двооксиду МnО2.
Б) каталітичне окиснення
За наявності срібла як каталізатора при температурі 150 – 350°С нижчі алкени окислюються киснем повітря, утворюючи оксиди алкенів, наприклад:
 .
.
При більш значному окисленні алкенів ланцюг атомів карбону розривається за місцем подвійного зв’язку і утворюються дві молекули оксигеновмісних речовин з меншою кількістю карбонових атомів у кожному.
В) горіння
С2Н4 + 3О2 → 2СО2 + 2Н2О
Г) окиснення алкенів в кислому середовищі (КМnO4 або К2Cr2O7)
CH2=CH2 + 4КМnO4 → 2CO2 + 4MnO2 + KOH
Д) окиснення КМnO4 за жорстких умов (нагрівання):
СН3–СН=СН2 → СН3–СООН + CO2
8. Озонування алкенів. Озон легко приєднується до молекули етиленового вуглеводню з утворенням озонідів:
 .
.
Озоніди – дуже вибухонебезпечні речовини, при нагріванні з водою розпадаються, утворюючи перекис гідрогену і альдегіди або кетони. За будовою одержаних при озонуванні альдегідів і кетонів можна судити про будову алкенів.
9. Оксосинтез. Оксосинтезом, або гідроформілуванням, називають каталітичну реакцію приєднання до алкенів карбон монооксиду і гідрогену (СО + Н2, водяний газ), у результаті якої утворюються переважно альдегіди. Реакцію провадять під тиском при нагріванні, наявності карбонілів кобальту або нікелю (метод Репне):
 .
.
10. Полімеризація алкенів. Молекули одного й того ж алкену за певних умов можуть сполучатися один з одним. Хімічний процес сполучення кількох однакових або різних молекул низькомолекулярних речовин (мономерів) з утворенням речовини більшої молекулярної маси, яка має такий же елементарний склад, як і вихідний мономер, називається реакцією полімеризації:

Коли полімеризуються молекули однієї якої-небудь речовини, реакція називається гомополімеризацією. При полімеризації двох або більшої кількості різних речовин реакція має назву сумісної полімеризації, або співполімеризації.
Здатність сполук до полімеризації обумовлена наявністю в них кратних зв’язків, або ж циклів, схильних до розмикання. При сполученні двох молекул продукт полімеризації називається димером, трьох молекул – тримером, при сполученні багатьох молекул – полімером.
Рівняння реакції полімеризації в найбільш загальному вигляді може бути подано так:
nA ® (A)n,
де А – молекула мономеру, Аn – кількість з’єднаних молекул мономеру, тобто ступінь полімеризації або коефіцієнт полімеризації залежить від природи речовини і від умов полімеризації.
За механізмом реакції розрізняють східчасту та ланцюгову полімеризації.
Східчаста полімеризація виникає в результаті відщеплення атома гідрогену або яких-небудь груп атомів від одної молекули і переходу їх до іншої молекули, що може привести до звільнення зв’язків в обох молекулах і з’єднанню їх один з одним. За східчастим механізмом відбувається полімеризація алкенів при високій температурі в присутності сульфатної кислоти, полімеризація формальдегіду, а також полімеризація таких сполук, як оксид етилену, 2-капролактану та ін.
Східчаста полімеризація в більшості випадків призводить до утворення порівняно низькомолекулярних полімерів.
Найбільше значення для добування високомолекулярних сполук має ланцюгова реакція полімеризації, при якій відбувається безперервне приєднання молекул мономеру до активного кінця ростучої молекули.
Цей вид полімеризації характеризується тим, що енергія після протікання одного акту приєднання не розсіюється в оточуюче середовище, а передається іншій молекулі і збуджує новий акт приєднання.
Ланцюговий процес полімеризації в загальному вигляді може бути показано за трьома етапами: 1) початок росту ланцюга (утворення активних центрів); 2) ріст ланцюга; 3) обрив ланцюга.
Для росту ланцюга необхідно активувати молекули мономерів. Використовують для цього ініціатор, каталізатор або фізичні методи впливу (світло, тепло і т.п.).
Ініціаторами полімеризації виступають нестійкі сполуки (перекиси), здатні розпадатися з виділенням вільних радикалів, які мають неспарений електрон.
Утворений вільний радикал реагує з молекулою мономеру, внаслідок чого утворюється новий вільний радикал з неспареним електроном.
Ріст ланцюга відбувається в результаті багаторазового повторення реакції приєднання мономеру до кінця ростучої молекули. Третій етап ланцюгової реакції – обрив ланцюга – здійснюється внаслідок насичення вільних валентностей радикалів. Полімеризаційні процеси лежать в основі виробництва таких важливих для народного господарства продуктів, як синтетичні каучуки, синтетичні волокна, мастила і т.п.
10. Ізомеризація. Під впливом різних каталізаторів (кислоти, хлористий цинк та ін.), особливо при нагріванні, часто відбувається процес ізомеризації вуглеводнів, який полягає в зміні будови молекули вуглеводню без зміни його молекулярної маси та складу. При ізомеризації може змінюватися положення подвійних зв’язків між карбоновими атомами, можуть утворюватися бокові ланцюги, відбуватися циклізація або розрив циклу. Як приклад, можна навести ізомеризацію n-бутилену в ізобутилен:

n-пентилену в циклопентан
 .
.
Застосування алкенів. Алкени широко використовуються в промисловості як вихідні речовини для одержання розчинників (спирти, дихлоретан, ефіри, гліколі та ін.), полімерів (поліетилен, полівінілхлорид, поліізобутилен і ін.), а також багатьох інших найважливіших продуктів.
Етилен, пропілен та ізобутилен широко використовуються в промисловому органічному синтезі:



Етен –безбарвний газ з слабким, злегка солодкуватим запахом. Утворює з повітрям вибухові суміші. У медицині та ветеринарії використовують як наркотичний лікарський засіб. В рослинництві використовують для прискорення дозрівання плодів. Це дає змогу транспортувати недозрілі плоди до місця призначення, де потім вони дозрівають в атмосфері етену.
Пропен – безбарвний газ зі слабким запахом. Пропілен – компонент моторного палива. Використовують для одержання поліпропілену, ізопропілового спирту, ізопропілбензолу. З ізопропілового спирту одержують ацетон, а з ізопропілбензолу – ацетон та фенол. Пропілен використовують як наркотичний засіб , для одержання акрилнітрилу, кумолу, бутанолів. Використовують для виготовлення водопровідних труб, ізоляції, рибацьких неводів, є добавкою до асфальту.
Бутени – безбарвні гази зі слабким запахом, вибухонебезпечні. Використовують для одержання бутадієнів, бутадієнових каучуків, ізооктану.
4. Загальна характеристика та класифікація дієнів
Алкадієновими вуглеводнями (дієнами, діолефінами) називаються ненасичені вуглеводні, які мають два подвійні зв’язки. Склад їх виражається формулою СnН2n-2.
Системи з двома подвійними зв’язками можуть бути трьох видів:
1) кумулени, або алени, в молекулах яких два подвійні зв’язки розміщені біля одного атома карбону. Наприклад, пропадієн-1,2; 2) спряжені (кон’юговані) дієни містять подвійні зв’язки через один атом карбону. Наприклад, бутадієн-1,3; 3) дієни з ізольованими подвійними зв’язками, коли подвійні зв’язки розміщені через два і більше атомів Карбону. Наприклад, пентадієн-1,4:
 |  |  |
| пропадієн-1,2 | бутадієн-1,3 | пентадієн-1,4 |
Серед вуглеводнів з двома кратними зв’язками найбільше значення мають вуглеводні з спряженими подвійними зв’язками:
 |  |  |
| бутадієн-1,3 або дивініл | 2-метилбутадієн-1,3 або ізопрен | 2,3-диметилбутадієн-1,3 |
Дивініл, або бутадієн-1,3 – найпростіший дієновий вуглеводень зі спряженою системою двох подвійних зв’язків. Він являє собою газ з температурою кипіння – 4,5°C. Дивініл є основною сировиною каучуку.
Назви дієнам дають за тривіальною номенклатурою та номенклатурою IUPAC. За номенклатурою IUPAC дієни називають як алкени, замінюють суфікс –ен на -дієн, місця подвійних зв’язків позначають номерами тих карбонових атомів, від яких починаються ці подвійні зв’язки, наприклад:
 |  |
| 2-метилбутадієн-1,3 | 3-метилпентадієн-1,4 |
Деякі сполуки називають за тривіальною номенклатурою, напириклад дивініл, ізопрен: СН3
СН2=СН–СН=СН2 СН2=С–СН=СН2
1,3-бутадієн (дивініл) 2-метил-1,3-бутадієн (ізопрен)
5. Способи добування дієнових вуглеводнів
Існує декілька способів одержання дивінілу. Одним з основних технічних способів виробництва бутадієну-1,3 є дегідрування n-бутану або n-бутилену. Велика кількість бутану, який добувають при прямій перегонці і крекінгові нафти, а також при стабілізації газового бензину, являє собою практично необмежені ресурси сировини для промисловості синтетичного каучуку.
Процес добування бутадієну дегідруванням вуглеводнів здійснюється в промисловому масштабі у трьох варіантах:
1. Дегідрування n-бутану в два ступеня:
| а) |  |
Як каталізатор застосовують оксид алюмінію, на який осаджений оксид хрому або інші оксиди металів IV, V і VI груп періодичної системи:
| б) |  |
Як каталізатор застосовують суміш оксидів металів, наприклад суміш 72,4% MgO, 18,6% Fе2O3, 4,2% К2О (активатор) і 4,8% CuO (стабілізатор).
2. Дегідрування n-бутену (див. 1.б)
3. Дегідрування n-бутану в один ступінь

Одноступінчасте дегідрування бутану в бутадієн провадять при температурі близько 600°С і під пониженим тиском (порядку 0,2 ат.). Як каталізатор застосовують оксид хрому, нанесений на оксид алюмінію.
4. Синтез Лебедєва. У промисловості дивініл одержують також каталітичним розкладанням етилового спирту за способом С.В. Лебедєва. Перетворення етилового спирту на бутадієн відбувається при температурі 400 – 500 оС за наявності дегідрогенізуючих та дегідратуючих каталізаторів (MgO + ZnO):

Реакція включає в себе такі стадії: дегідрування спирту до альдегіду, альдольну конденсацію альдегіду, відновлення альдолю до 1,3-бутандіолу і дегідратацію 1,3-бутандіолу.
5. Можливе також одержання бутадієну-1,3 з ацетилену через вінілацетилен:

Поряд з утворенням бутадієну-1,3 відбувається багато інших побічних реакцій, внаслідок яких утворюються різні сполуки: вуглеводні, спирти, альдегіди, ефіри, оксиди вуглеводнів та ін. Ці побічні продукти використовуються в хімічній промисловості, що значно знижує собівартість дивінілу.
6. Дегідратація 1,2-, 1,3- або 1,4-діолів (двоатомних спиртів):
СН2–СН2– СН2– СН2 → СН2=СН–СН=СН2 + Н2О
ОН ОН
Ця реакція відбувається при нагріванні та кислому середовищі.
7. Фізичні та Хімічні властивості дієнів.
1,2-пропадієн (ален) та бутадієн – безбарвні гази, наступні представники гомологічного ряду – рідини, вищі дієни – тверді речовини.
Крім загальних реакцій, властивих сполукам з подвійними зв’язками, дієнові вуглеводні мають ряд індивідуальних хімічних властивостей.
1. Приєднання гідрогену, галогенів і галогеноводнів. Приєднання однієї молекули гідрогену, галогену або галогеноводнів може відбуватися в положенні 1, 2 або 3, 4, тобто за одним, подвійним зв’язком, або в положенні 1, 4, тобто на кінцях спряженої системи, наприклад:
 ,
,
 ,
,
 .
.
Як правило, переважає приєднання в положенні 1,4 з переміщенням подвійного зв’язку.
2. Дієновий синтез(реакція Дільса-Адлера). Дієнові вуглеводні зі спряженими подвійними зв’язками здатні приєднувати до першого й четвертого атомів карбону сполуки, які містять етиленові або ацетиленові зв’язки активованими групами =CO, –СООН, –CN або –NO2, внаслідок чого утворюються циклічні сполуки. Так, при нагріванні дивінілу з акролеїном до 100°С утворюється циклічна сполука:
 .
.
При взаємодії дивінілу з ацетилендикарбоновою кислотою утворюється 3,6-дигідрофталева кислота:
 .
.
Зараз дієновий синтез застосовується в техніці для добування ароматизованих і лікарських речовин.
3. Полімеризація. Дієнові вуглеводні за наявності каталізаторів – металічного натрію, перекисів натрію або бензолу та ін. – легко піддаються полімеризації. Ця важлива властивість дієнових вуглеводнів зі спряженими подвійними зв’язками використовується при виробництві синтетичного каучуку.
 | 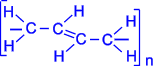 . . |
4. Співполімеризація. Дієнові вуглеводні вступають у реакцію співполімеризації з стиролом, ізобутиленом, акрилонітрилом, утворюючи синтетичні каучуки з різноманітними властивостями.
Окремі представники:
Бутадієн-1,3–безбарвний газ з характерним запахом, не розчинний у воді, розчинний в органічних розчинниках. Одержують зі спирту методом Лебедєва, дегідруванням бутану, а також з продуктів нафтопереробки. Є цінною сировиною для одержання синтетичного каучуку.
Ізопрен – безбарвна, летка рідина. Вперше одержаний з каучуку методом сухої перегонки. Використовують для одержання синтетичного каучуку, запашних речовин та лікарських засобів.
Каучук. Каучук набув виключно широкого застосування. З природного та синтетичного каучуку виготовляють різноманітні гумові, гумовотканинні та гумово-металеві вироби: автомобільні, авіаційні та інші шини, привідні ремні, транспортні стрічки, рукави, шланги, деталі різних машин та апаратів, прокладки, муфти, кабелі та проводи з гумовою ізоляцією, прогумовані тканини, гумове взуття, предмети санітарно-гігієнічного призначення.
Натуральний каучук. Натуральний каучук добувається головним чином з молочного соку (латекса) тропічного каучуконосного дерева – гевеї бразильської, яку спеціально культивують у Південній Америці, Індонезії, на островах Малайського архіпелагу та в інших країнах тропічного поясу.
Молочний сік у гевеї добувається шляхом підсочки дерев, латекс, що витікає, збирають в алюмінієві чашечки, прикріплені до дерева.
Молочний сік гевеї бразильської містить 52 – 60% води, 34 – 37% каучуку, 2,0 – 2,7% білків, 1,7 – 3,4% смол, 1,5 – 4,0% цукрів і 0,2 – 0,7% золи.
Зібраний латекс проціджують крізь сітку і для запобігання передчасної довільної коагуляції додають до нього невелику кількість 2%-ного водного розчину аміаку.
Для добування натурального каучуку молочний сік піддають коагуляції, додаючи при перемішуванні невелику кількість коагулятора – розведеної мурашиної або оцтової кислоти.
Одержаний крихкий згусток промивають водою і прокатують на вальцях у листи, які просушують і потім коптять в камерах, наповнених димом. Готові листи каучуку, які мають світло-коричневе забарвлення, відомі під назвою смокедшиту (з англ. – копчений лист).
Натуральний каучук являє собою високомолекулярний ненасичений вуглеводень складу (C5H8)n. Основною структурною групою макромолекули каучуку є ізопренова група (у цис-ізомерній формі). Понад тисячу таких груп, сполучених послідовно між собою в положенні 4 – 1, утворюють макромолекулу каучуку:
 .
.
Середня молекулярна маса натурального каучуку – від 150 000 до 500 000.
Синтетичні каучуки.
Добування синтетичного каучуку складається з двох основних процесів: одержання каучукогенів (мономерів) і полімеризації останніх у каучукоподібний продукт.
Як каучукогени зараз у промисловому масштабі застосовуються бутадієн, стирол, ізопрен, хлоропрен, акрилонітрил та ізобутилен.
Усі види синтетичного каучуку є сполуками ланцюгової будови, які утворюються внаслідок полімеризації каучукогенів.
Натрійбутадієновий каучук СКБ. Найбільш розповсюдженою різновидністю бутадієнових каучуків є натрійбутадієновий каучук СКБ, який добувають полімеризацією бутадієну при температурі близько 60°С і тиску 7 – 8 ат. у присутності металічного натрію. Натрійбутадієновий каучук СБК належить до каучуків загального значення. З нього виготовляють шини, різноманітні гумовотехнічні м’які та ебонітові вироби, гумове взуття, зовнішні оболонки кабелю та інше.
Бутадієнстирольний каучук, одержують у результаті сумісної полімеризації бутадієну і стиролу в емульсії. При цьому приблизно 75% бутадієну полімеризується в положення 1,4 а решта 25% – в 1,2. Бутадієнстирольний каучук належить до каучуків загального призначення. Він міцніший за натрійбутадієнові каучуки і широко застосовуються для виготовлення автомобільних покришок та камер, транспортерних стрічок, різних технічних виробів, ебоніту та ін. До останнього часу приблизно 80% всього світового виробництва синтетичного каучуку припадало на бутадієнстирольні каучуки.
Бутадіеннітрильні каучуки. Ці каучуки добувають шляхом сумісної полімеризації бутадієну та нітрилу акрилової кислоти у водній емульсії; при цьому бутадієн полімеризується головним чином в положення 1,4, і частково в 1,2. Бутадієннітрильний каучук належить до каучуків спеціального призначення. Він масло- та бензостійкий. Тому з нього виготовляють гумові деталі та вироби, які призначені для роботи в маслі та бензині. Завдяки добрій теплостійкості бутадієннітрильні каучуки застосовуються для виготовлення гумових виробів, які використовуються при високих температурах (до 100°С та вище).
Хлоропреновий каучук. Вище вказувалось, що при полімеризації ацетилену утворюється вінілацетилен. Шляхом приєднання до вінілацетилену хлороводню в присутності каталізатора хлористої міді добувають хлоропрен. При полімеризації хлоропрену у водній емульсії при 40°С утворюється хлоропреновий каучук. Хлоропреновий каучук має високу стійкість до дії світла, масел та розчинників. Недоліком хлоропренового каучуку є його незмішуваність (неможливість одержання однорідної суміші) з бутадієновими та натуральними каучуками. Хлоропреновий каучук застосовується для ізоляції кабелів і дротів, у виробництві різних масло- і бензостійких гумових деталей машин і апаратів, а також для обкладки валів у паперовій та текстильній промисловості.
Полісилоксанові каучуки. Новими каучукоподібними матеріалами є так звані полісилоксанові каучуки (силіконові каучуки, кремнекаучуки).
Силіконові каучуки являють собою високомолекулярні кремнійорганічні насичені сполуки, які утворюються при поліконденсації силандіолів – кремнійорганічних спиртів. Головний молекулярний ланцюг каучуку складається з переміжними атомами кремнію та оксигену, і лише побічні групи (R) являють собою вуглеводневі радикали, наприклад метильні, етильні, фенільні й ін. Полісилоксанові каучуки позначаються маркою СКТ (синтетичний каучук термостійкий). З полісилоксанових каучуків зараз найбільше застосування має диметилоксановий каучук СКТ. Гуми з цього каучуку зберігають свої властивості в інтервалі температур від –60°С до +250°С. Крім цього, каучук СКТ характеризується високими діелектричними показниками, гідрофобністю, стійкістю до озону, повітря та ультрафіолетових променів.
Диметилсилоксановий каучук СКТ застосовується для виготовлення прокладочних і ущільнюючих матеріалів, електроізоляційних матеріалів та інших виробів, стійких до високих температур.
Вулканізація. Вулканізацією називається процес взаємодії каучуку з сіркою або яким-небудь іншим хімічним агентом, що служить для перетворення каучуку в гуму. В результаті вулканізації каучук змінює свої фізико-хімічні властивості, стає еластичним і міцним, набуває інших характерних для гум властивостей:
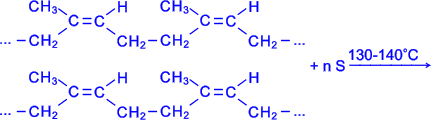
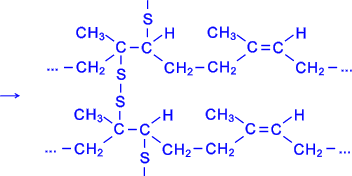
Одержана в результаті вулканізації гума на відміну від каучуку нездатна розчинятися при звичайній температурі в органічних розчинниках і не є клейкою.
Як правило, процесу вулканізації піддається не сам чистий каучук, а суміш його з іншими речовинами, які забезпечують необхідні експлуатаційні властивості вулканізату (наповнювачі типу сажі, крейди, каоліну; м’якшильне – різні смоли, висококиплячі вуглеводні; протистарителі, які захищають каучук від окислення, і т.д.). У переважній більшості випадків вулканізація полягає в тому, що гумові суміші, які містять сульфур або інші вулканізуючі агенти, піддають нагріванню при 130 – 160°С. При введенні в гумову суміш невеликої кількості сірки (від 1 до 3%) в результаті вулканізації добувають м’яку еластичну гуму, а при введенні більшої кількості (30 – 45%) – твердий продукт, який називається ебонітом.
Існують інші способи вулканізації, наприклад холодна й газова, вулканізація в розплавленій сірці.
Крім сірки, як основного вулканізуючого агента, до каучуку добавляють незначну кількість прискорювачів, які забезпечують не тільки скорочення часу вулканізації, а й поліпшення фізико-хімічних властивостей вулканізації. Як прискорювач застосовують дифенілгуанідин, меркаптобензотіазол, тетраметилтіурамдисульфід та ін. Прискорююча дія цих речовин повною мірою виявляється лише в присутності активатора. Як активатор вулканізації застосовують переважно оксид цинку.
Активація вулканізації виражається в додатковій (крім дії прискорювачів) інтенсифікації процесу і поліпшенні технічних властивостей одержуваних гум.
Вважають, що вулканізація – це головним чином хімічний процес: колоїдно-фізичні властивості відіграють певну роль, але не є визначаючими. Основною хімічною реакцією є приєднання сульфуру до каучуку. Одночасно протікають термоокислювальні й полімеризаційні процеси.
