Осы айырымдарды қолданып реакцияның жылу эффектісін қажетті температурада есептеуге болды
Мысалы, деп белгілесек, Т температурадағы ; Dу есептегенде стехиометриялық коэффиценттер ескеріледі.
9. Әр түрлі температурада химиялық процестің және фазалық ауысулардың жылу эффектілерін есептеу жолдары. Кез-келген химиялық процестіңжылу эффектісі температураға тәуелді. Бұл тәуелділікті Кирхгоф теңдеуі көрсетеді: QP = ΔH, QV= ΔU
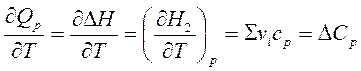 ,Бұл теңдеу арқылы жылу эффектісінің Т1-Т2 аралығында қалай өзгеретінін ж/е Т2 температурадағы жылу эффектісінің мәнін анықтауға мүмкіндік береді. Ол үшін алғашқы теңдеуден интеграл алуымыз керек.:
,Бұл теңдеу арқылы жылу эффектісінің Т1-Т2 аралығында қалай өзгеретінін ж/е Т2 температурадағы жылу эффектісінің мәнін анықтауға мүмкіндік береді. Ол үшін алғашқы теңдеуден интеграл алуымыз керек.: 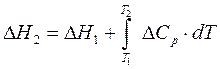
Т2 және Т1 температурадағы жылу эффектісі , Т1 ж/е Т2 температуралардағы жылу сыйымдылық белгілі болуы керек.
Кирхгоф теңдеуі үш түрлі жағдайларда қолданылады және осы үш жағдай үшін алынған теңдеулер бірінші, екінші, үшінші ретті болып табылады.
Бірінші ретті жуықтау. Бастапқы заттардың жылу сыйымдылықтарының қосындысы түзілген заттардың жылу сыйымдылықтарының қосындысына тең болса ΔСР = 0 болады. Ал ΔН1 =ΔН2 = const болады. Яғни реакцияның жылу эффектісі температураға тәуелді емес.
Екінші ретті жуықтауда Т1-Т2 аралығы аз болып, температураға тәуелді емес болғанда қолданылады. Реакцияның жылу эффектісін есептеу келесі жолмен жүзеге асырылады: 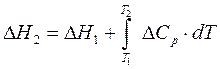 → ΔН2 =ΔН1 + CP (Т2 – Т1)
→ ΔН2 =ΔН1 + CP (Т2 – Т1)
Үшінші ретті жуықтау Т1-Т2 аралығы өте көп болып, осы аралықта фазалық ауысулар орын алған жағдайда қолданылады.Бұнда СР жылу сыйымдылықтың температураға тәуелділігі ескеріледі. СР = f(T) . Ол тәуелділік тәжірибе жүзінде анықталған мына қатармен беріледі Δ СР = Δa+ ΔbT + ΔcT2 + ΔdT3
a, b, c, d – зат табиғатына байланысты эмпирикалық коэффициентер. Сонда Т2 жылу эффектісі тең: ΔН2 =ΔН1 + ΔaТ2+
Егер Т1-Т2 температуралық аралықта фазалық ауысулар орын алған болса Кирхгоф теңдеуі келесі жолмен өрнектеледі:
ΔН2 =ΔН1 + dT + ΔНҚ.К. + dT + ΔНБАЛ. + dT + ΔНБУЛАНУ + dT
Бұндағы ΔНҚ.К.,ΔНБАЛ. , ΔНБУЛАНУ – қайта кристалдану, балқу ж/е булану жылулары. – заттың төменгі температуралық кристалдық, жоғары температуралық кристалдық, сұйық ж/е газ күйлеріндегі жылу сыйымдылықтары.
10. Идеал газдар қатысымен өтетін әр түрлі процестер үшін термодинамиканың 1-ші заңы. Термодинамиканың бірінші заңы - жүйенің сыртқы ортадан алған жылу мөлшері оның ішкі энергиясының өзгеруіне ж/е сыртқы ортаға кететін жұмысты өндіруге жұмсалады. : Q = ΔU– A.
Енді термодинамиканың бірінші заңын идеал газдардағы изопроцестер үшін қолданайық:
· Изохоралық процестерде (V=const) газ жұмыс жасамайды А=0, сәйкес
Q = ΔU = UT1 – UT2
Бұндағы UT1 ж/е UT2 газдың бастапқы ж/е соңғы күйдегі ішкі энергиялары. Идеал газдардың ішкі энергиясы тек температураға тәуелді ( Джоуль заңы). Изохоралық қыздыру кезінде газ жылуды жұтады(Q>0) ж/е оның ішкі энергиясы артады. Ал суытқан кезде(Q<0) жылу газдан сыртқа бетіледі, сәйкес ішкі энергия кемиді.
· Изобаралық процестер үшін (p=const) газдың жасайтын жұмысы былай өрнектеледі: A = p (V2 –V1) = pΔV
Ал термодинамиканың бірінші заңы бұндай процесс үшін : Q = UT1 – UT2 + p (V2 –V1) = ΔU - pΔV
Изобаралық ұлғаю кезінде (Q>0) газ жылуды жұтып, оң жұмыс жасайды. Ал изобаралық сығылу кезінде (Q<0) жылу сыртқы ортадан газға беріледі. Нәтижесінде А<0 . Изобаралық сығылу кезінде газ температурасы кемиді Т2 <Т1, ішкі энергия азаяды ΔU<0.
· Изотермиялық процестерде газ температурасы өзгермейді, сәйкесінше ішкі энергияда өзгермейді ΔU =0. Изотермиялық процестер үшін термодинамиканың бірінші заңыкелесі теңдікпен беріледі : Q = A. Изотермиялық ұлғаю кезінде алынған жылу сыртқы ортаға жұмсалатын жұмысқа кетеді. Ал сығу кезінде газды сығуға кеткен күштер сыртқы ортаға берілетін жылуға айналады.
Термодинамикада изопроцестермен қатар адиабаталық процестер қарастырылады. Адиабаталық процес – сыртқы ортамен жылу алмасу болмайтын процесс. Оған адиабаталық ұлғаю және сығылу процестері жатады. Бұндай процестерде Q = 0 , сондықтан термодинамиканың бірінші заңы былай өрнектеледі: A = - ΔU. Яғни газ ішкі энергиясының кемуі есебінен жұмыс жасайды. Адиабаталық ұлғаю кезінде газ оң жұмыс жасайды, сондықтан оның ішкі энергиясы кемиді, осыдан газ температурасы төмендейді. Нәтижесінде адиабаталық процесс кезінде изотермиялық процеске қарағанда қысым тезірек төмендейді.
Термодинамиканың екінші заңы, оның анықтамалары және математикалық өрнектері. Қайтымды және қайтымсыз процестердің энтропиясының өзгерісі. Процестің бағыты мен оның жүру шегін анықтауда терм-ң 1ші заңы жеткіліксіз б-ды. Бұл терм-ң 2ші заңының орнатылуына себеп болды. Терм-ң 2ші бастамасы оның 1ші бастамасы секілді постулат болып табылады. Яғни одан шығатын тұжырымдамалардың барлығы осы күнге дейін тәжірибеде дәлелденіп келеді.1824ж С.Карно терм-ң 2ші бастамасының негізгі қағидасын орнатты. XIXғ ортасында Клаузиус,Томсон мен Максвелл терм-ң 2ші заңы табиғаттың жалпы заңдарының бірі екенін атап өтті.
Терм-ң 2ші заңының көптеген анықтамалары бар.Олардың барлығы бір-біріне тең шамалы ж/е логикалық түрде тұжырымдалады. Анықтамаларға тоқталсақ:
Клаузиус анықтамасы: жылу өздігінен,яғни ешқандай теңесусіз,суық денеден ыстық денеге ауыспайды.Ал ауысатын б-са,онда міндетті түрде жүйеде қосымша өзгерістер б-ды.
Томсон анық-сы: ешқандай процестердің арақатынасы тек жылудың жұмысқа өтуіне негізделмейді,ал жұмыстың жылуға айналуы процестердің жалғыз нәтижесі болуы мүмкін.
Оствальд анық-сы: Екінші текті мәңгілік қозғалтқтышты құру мүмкін емес. Екінші текті қозғалтқыш ретінде тек сыртқы ортадан берілетін жылу арқылы ғана жұмыс жасайтын машина қарастырылады.
Енді осы анықтамаларды мағынасын түсіндірсек. Негізінде жылудың жұмысқа өтуі мүмкін.Ол процес кез-келген жылулық машиналардың жұмысы кезінде өтеді.Яғни машина өз жұмысын белгілі бір жылубергіштен жылу сіңіруі арқ жасайды.Бірақ жұмыс денесі алатын q1 жылуы жұмысқа толығымен айналмайды,оның бір бөлігі ғана А= q1- q2.Ал жылудың қалған бөлігі q2 темп-сы төмен денеге өтеді(жылуқабылдағыш).Қорыта айтқанда ондай машинаның жұмысы бірмезгілде жылу бергіштен q1 жылуын алып А жұмысын жасау мен белгілі бір q2 жылуын темп-сы төмен жылу қабылдағышқа беруге негізделеді.
Жасалынған жұмыс мөлшерінің жұмыс денесіне жылу бергіш 0 берген q1
Жылу мөлшерінің қатынасы пайдалы әсер коэффиценті деп аталады.Осы шаманы қолдана отырып терм-ң 2ші заңына мынадай анықтама беруге болады:жылулық машинаның ПӘК-нің ең үлкен мәні жұмысқа қатысатын дене мен заттың табиғаты мен түріне тәуелді емес,ол тек қана жылубергіш пен жылуқабылдағыштың темп-на тәуелді.
Қайтымды ж/е қайтымсыз процестердің энтропиясының өзгерісі. Қайтымсыз процестердің энтропиясын есептеуге болмайды.Бірақ қайтымды ж/е қайтымсыз процестерде энтропия өзгерісі бірдей б/ды,өйткені энтропия күй функциясы. Сонда реал қайтымсыз процестің энтрописын есептеу үшін процесті ойша қайтымды етіп жүргізіп,қайтымды процес үшін энтропия теңдеуімен оның өзгерісін есептеуге б-ды.Әртүрлі процестер үшін энтропия өзгерісін есептеу:
Қайтымсыз процестер үшін энтропияның өзгерісі процестің жылуымен мына теңсіздіктер арқ 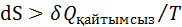 н/е
н/е 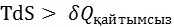 (1)
(1)
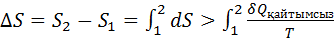 (2)
(2)
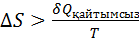 ж/е T
ж/е T 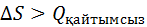 (3)
(3)
байланысқан.Сондықтан мәліметтер б-ша қайтымсыз процестердің энтропиясын есептеуге болмайды.Бірақ қайтымды ж/е қайтымсыз процестерде энтропия өзгерісі бірдей б/ды,өйт энтропия күй функциясы. Сонда реал қайтымсыз процестің энтрописын есептеу үшін процесті ойша қайтымды етіп жүргізіп,қайтымды процес үшін энтропия теңдеуімен оның өзгерісін есептеуге б-ды.Әртүрлі процестер үшін энтропия өзгерісін есептеу:
1.Кез-келген заттың изотермиялық процесі үшін(Т=const).Ойша изотермиялық процесті қайтымды етіп жүргізіп,энтропия өзгерісін мына теңдікпен есептейміз: 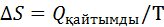
2.Тұрақты көлемде кез келген затты Т1 темп-дан Т2 темп-ға қыздырған кезде.Бұл жағдайда процестің жылуы күй функциясының қасиеттеріне ие б/ды ж/е процес жолына тәуелсіз б/ды. 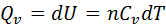 теңдігендегі
теңдігендегі 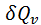 шамасын
шамасын 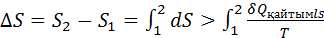 теңдігіне қойсақ мына теңдік шығады:
теңдігіне қойсақ мына теңдік шығады: 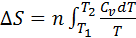
Егер 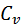 = const деп жуықтасақ,онда
= const деп жуықтасақ,онда 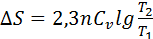 тең болады.
тең болады.
3.Тұрақты қысым кезде(p=const): 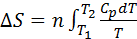
Егер 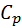 = constб/са,онда
= constб/са,онда 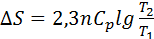
4.Идеал газдарға арналған әртүрлі процестер үшін энтропия өзгерісі мына теңдіктерден шығады: 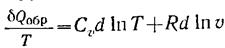 ж/е
ж/е 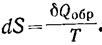
Сонда: 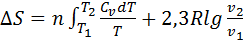
Егер 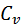 = constб/са,онда
= constб/са,онда 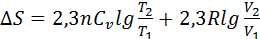
Идеал газ үшін 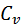 =
= 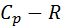 ж/е
ж/е 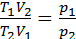 екенін ескере отырып теңдікті былай жазуға да болады:
екенін ескере отырып теңдікті былай жазуға да болады: 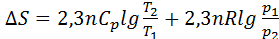
Изотермиялық процесте 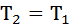 = const ж/е
= const ж/е 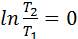 екенін ескере отырып, мына формуланы қорытамыз:
екенін ескере отырып, мына формуланы қорытамыз: 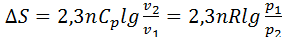
Изохоралық процесте 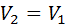 = constж/е
= constж/е 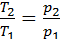 ,сонда
,сонда
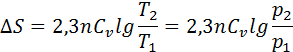
Изобаралық процесте 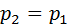 = constж/е
= constж/е 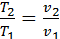 болғандықтан,
болғандықтан,
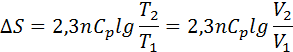
Тұрақты қысым мен темп-да өтетін қайтымсыз химиялық р-яның энтропия өзгерісін анықтау үшін ойша сол р-яны қайтымды етіп жүргізу керек.Сонда
δQ=dU+δA ж/е δAқайтымды=δА’m+pdV теңдіктерінен шығады:
δQқайтымды=dU+ δА’m+pdV
T=const пен p=const болғанда:
δQқайтымды=dH+ δА’m бұдан
