Производные пиримидинметилтиазола
В основе:
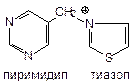
Тиамина хлорид, Тиамина бромид - витамин В1; Кокарбоксилазы гидрохлорид (кофермент), Фосфотиамин, Бенфотиамин.
Производные пиримидина:
-барбитураты
-производные урацила
-гексамидин
-циклопурин
-аллопуринол
-циклоптеридин (фолиевая к-та)
Общая характеристика:
1. Тиамин - выделен в 1812 г., синтез - в 1936 г. Содержится в дрожжах, отрубях. В1 должен поступать в организм извне. В кишечнике он фосфорилируется и превращается в кофермент тиаминдифосфат.
2. Фосфотиамин и бенфотиамин быстрее в организме превращаются в кокарбоксилазу и менее токсичны, чем витамин В1.
Тиамина хлорид (бромид) - Thiamini chloridum (bromidum)
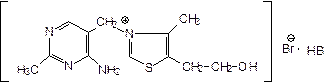
4-метил-5-b-оксиэтил-N-(2-метил-4-амино-5-метилпиримидил)-тиазолий бромида гидробромид.
НBr добавляют для получения устойчивой соли. ЛФ - 3-6% раствор для инъекций, драже.
Тиамина гидрохлорид - таблетки, драже, 2,5% раствор для инъекций.
Строение и свойства
1. Препарат являются двойными солями: а) четвертичный азот тиазолового цикла обуславливает образование четвертичных аммониевых солей, б) основные свойства пиримидинового цикла обуславливают образование комплексных солей с кислотами (HCl, бромной), которые придают устойчивость ЛП.
Особенность препаратов: они являются солями, но выделить основание нельзя, т.к. происходит разрушение цикла тиазола, который не устойчив в щелочной среде (см. образование тиохрома).
2. Пиримидин более сильное основание, чем пиридин, т.к. идет взаимное отталкивание электронной плотности атомами азота. Пиримидин реагирует только с 1 моль к-ты.
3. В своей структуре имеют спиртовой гидроксил Þ образуют сложные эфиры с кислотами.
4. В1 устойчив в кислой среде и при температуре 120оС. Но: в щелочной и нейтральной за счет неустойчивого цикла тиазола легко разрушается. На свету - аналогично. Препараты разлагаются Þ тиохром.
Физические свойства:
Белые кристаллические вещества с желтым оттенком, имеют характерный запах, легко растворимы в воде (реакция среды кислая, рН = 2,7 - 3,6). Трудно растворимы в спирте.
Кокарбоксилалазы гидрохлорид - Cocarboxylasi hydrochloridum
Это кофермент, участвует в декарбоксилирование пировиноградной к-ты. Это тиаминдифосфата гидрохлорид.
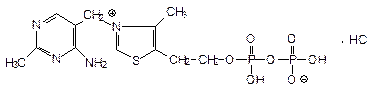
Описание: Это белый кристаллический порошок, хорошо растворимый в воде. Реакция среды кислая. Выпускается в ампулах в виде порошка. Готовят ex tempore (т.к. термолабилен).
Это: кофермент + Mg2+ + белок Þ фермент кокарбоксилаза. Осуществляет катализ карбоксила и декарбоксилирование a-кетокислот. Вводят в/м и в/в.
Хранение: при температуре не более +5оС.
Фосфтиамин -Phosphothyaminum
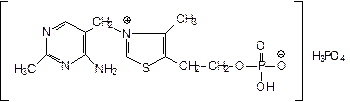
Это монофосфорный эфир тиаминфосфата.
Описание: белый кристаллический порошок, легко растворим в воде (т.к. соль), не растворим в спирте. По свойствам близок к тиамину. ЛФ - таблетки.
Бенфотиамин - Benphothyaminum
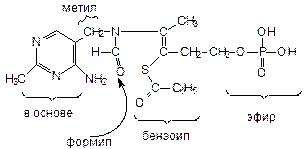
2-метил-4-амино-5-(1’-фосфат-3’-бензоилтио-4’-метил-бут-3’-ен-4’-формамидометил)-пиридин
Описание: белый кристаллический порошок со слабым запахом, не растворимый в воде, очень легко растворим в спирте, растворим в щелочи за счет остатка фосфорной к-ты. ЛФ - таблетки.
Химические свойства производные тиамина:
Препараты нестабильны. Разложение вызывают: восстановители, щелочная среда (!), кислород воздуха, УФ. Оптимальное рН = 4,0. Разложению могут способствовать тяжелые Ме. Для стабилизации добавляют ЭДТА, цистеин. Основной продукт разложения - тиохром (см.).
Подлинность:
1. Соли азотсодержащих органический соединений - растворимы в воде, кислая реакция среды.
А) Нельзя выделить основание, т.к. разлагается под действием щелочи
Б) осадки с общеалкалоидными реактивами. Тиамин бромид - количественно образуется осадок с кремневольфрамовой к-той.
2. На остаток фосфорной к-ты.
А) Соли - фосфат ион.
Б) в Эфире - минерализация с HNO3 Þ образование фосфата.
3 фармакопейные реакции:
1) + AgNO3 Þ Ag3РО4 ¯
2) + Mg2+ + NH4+ Þ NH4MgPO4¯
3) (NH4)3PO4*12MoO3¯
3. На хлориды и бромиды - с AgNO3
4. Специальная общегрупповая реакция: образование тиохрома (ну наконец-то дошли!)
Препарат + вода + 1 мл K3[Fe(CN)6] (окислитель) + 1 мл 10% щелочи (3 эквивалента) + бутанол или изоамиловый спирт (легче воды) Þ встряхивают Þ в верхнем слое появляется синяя флуоресценция (ТИОХРОМ) Þ добавляем кислоты Þ окраска исчезает Þ добавляем еще щелочи Þ окраска возвращается.
Стадии: 1. Нейтрализация НBr : Препарат + NaOH Þ NaBr + вода + [тиамин+]Br-
2. Образование основания тиазола и псевдооснования:
+ NaOH Þ - NaBr Þ :
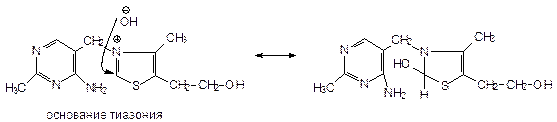
находится в равновесии с псевдооснованием.
3. Образование тиольной формы тиамина:
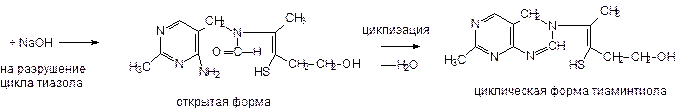
4. Окисление:
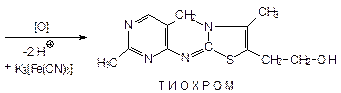
Образуется тиохром - в УФ - синяя флуоресценция. Подлинность и К.О.
Чистота: Посторонние примеси - ТСХ.
К.О.: 1. Кокарбоксилазы г/х - Метод нейтрализации. Т = NaOH. Индикатор - тимолфталеин. Титруются HCl и две ОН-
2. Фосфотиамин, Бенфотиамин - СФМ
3. Тиамина г/х - субстанция: Кислотно-основное титрование в неводных средах. Растворитель: лед. CH3COOH,
Т = HClO4 . Добавляют ацетат ртути. Индикатор кристаллический фиолетовый.
Конечный продукт: [тиамин]ClO4-*HClO4 - тиамин перхлорат (2 моль HClO4 )
Раствор для инъекций - аналогично. Воду удаляют кипячением с уксусным ангидридом.
Таблетки - флюорометрия - по образовавшемуся тиохрому.
4. Тиамина бромид - а) Субстанция - весовой метод - длительный. Навеска + конц. HCl Þ кипятят Þ + кремневольфрамовая к-та Þ осадок 12WO3*SiO2(OH)2*2тиамина*4H2O
б) Метод аргентометрии - прямое титрование: 1 стадия - нейтрализация бромной к-ты - в препарату не учитывается, т.к. бромная к-та добавляется для стабилизации.
(тиамин)Br*НBr + NaOH Þ NаBr + вода + тиамина бромид. Индикатор - бромтимоловый синий.
2 стадия - Получение индикатора тиоцианата железа: NH4SCN + Fe(NH4)(SO4)2 Þ Fe(SCN)3 + (NH4)2SO4
3 стадия - титрование тиамина бромида и натрия бромида AgNO3 . Образуется тиамина нитрат и AgBr ¯
4 стадия - продолжают титровать до разрушения индикатора:
3AgNO3 + Fe(SCN)3 Þ 3AgSCN¯ белый + Fe(NO3)3
Титруют до обесцвечивания индикатора. Объем AgNO3 на тиамина бромиде = объему AgNO3 - объем NaOH - 0,1 мл родонита аммония.
Другие методы: СФМ в УФ
Антивитамины: не применяются как ЛВ.
Отличаются:
1. Пиритиамин - цикл тиазола заменен на пиридин
2. Окситиамин - аминогруппа замещена на гидроксил
3. 2-трифторметилтиамин - в положении 2 в цикле тиазола введена трифторгруппа.
Ориентировка:
1. Производные птеридина
-Фолиевая к-та, Метотрексат.
2. Производные изоаллоксазина
-Рибофлавин (витамин В2), Рибофлавин мононуклеотид
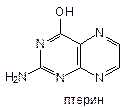 |
Производные птеридина
-в основе структуры: птеридин - бициклическая система.
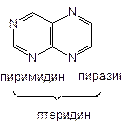 |
Птеридин - хорошо растворим в воде (1:7), при введении ОН-группы растворимость падает, т.к. образуются межмолекулярные связи между функциональными группами и азотом.
Природные соединения являются производными птерина. Птерины - это флюоресцирующие окрашенные части насекомых (лимонницы и капустницы).
Биологическая роль в организме: 1. Является факторами роста микроорганизмов - тетрагидрофолиевая к-та (см. механизм действия сульфаниламидов). Главный представитель - фолиевая к-та - 1949 г. - литься шпината.
2. Это антианемический витамин (фактор) - при недостатке фолиевой к-ты м.б. анемия
Строение фолиевой к-ты и родственных соединений:
К-та фолиевая - Acidum folicum (folium- лист)
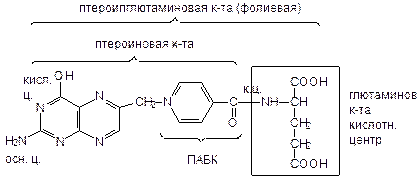 |
Глютаминовая к-та лежит в основе рационального названия:
N-{4’-[2-амино-4-окси-6-птероидил)-метил]-амино}-бензоил-L-(+)-глютаминовая к-та
Витамины группы фолиевой к-ты отличаются количеством остатком глютаминовой к-ты (м.б. до 7-ми).
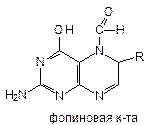 |
Коферментные формы фолиевой к-ты:
1. 5,6,7,8-тетрагидрофолиевая к-та
2. Фолиновая к-та - это 5-формил-5,6,7,8-тетрагидрофолиевая к-та. Получен как ЛП.
Физические свойства:
Фолиевая к-та - это желтый порошок (за счет птеридина), без запаха, без вкуса, гигроскопичен, на свету разлагается, не растворим в воде. Амфотерное соединение с преобладанием кислотных свойств. Очень легко растворимо в минеральных к-тах. Легко - в NaOH, NH3 , карбонатах щелочных металлов. Разрушается под действием: кислот, восстановителей, окислителей, света.
Подлинность:
1. Физико-химические показатели: температура плавления, ИК, УФ спектры в 0,1н щелочи.
2. Кислотно-основные свойства - в основном это кислота: а) растворяется в щелочах и аммиаке, б) реакции соле- и комплексообразования с солями тяжелых Ме: препарат + эквивалент щелочи Þ динатриевая соль (хорошо растворимая в воде) + CuSO4 (Co, Fe) Þ реакции не специфичны.
3. Гидролиз и окисление - образование птерин-6-карбоновой к-ты. Препарат + NaOH + 0,1н HCl + KMnO4 Þ нагревают на водяной бане Þ + H2O2 Þ фильтруютÞ в фильтрат имеет голубую флуоресценцию в УФ:
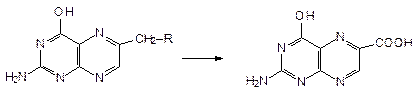
4. Реакция образования азокрасителя - см. К.О. Фолиевая к-та + HCl (или + NaOH) + цинковая пыль - при нагревании. - образуется ПАБК.
К.О.: 1. Полярография. 2. ФЭК - по реакции образования азокрасителя. Навеска + вода + NH3 + KMnO4 Þ затем добавляют нитрит натрия в HCl - его избыток удаляют сульфамидной к-той (образуется N2) + 1 мл N-1-нафтилэтиленамин Þ азокраситель - определяют оптическую плотность.
1 стадия - окисление KMnO4 :
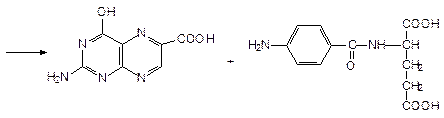
2 стадия:
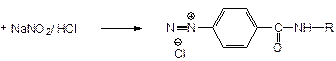
3 стадия:
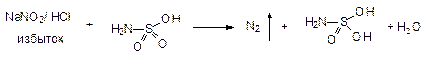
4 стадия:
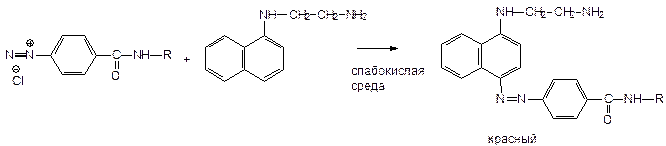
Раствор д.б. прозрачным, окраска - 10 минут, подчиняется закону (?).
3. Флюорометрия - на образование птерин-6-...
4. Микробиологический способ
ЛФ: таблетки, порошок, в комплексных ЛФ.
Антивитамины:
1. Аминоптерин - ОН заменен на амино-группу. Это цитостатик - для лечения лейкозов.
2. Аметоптерин - 4-амино-10-метил-фолиевая к-та. Это основа препарат «Метотрексата» Methotrexatum - это антиметаболит фолиевой к-ты. Самый сильный. Цитостатик. Это смесь: 4-дезокси-4-амино-N10 -метилформиевых к-ты (аметоптерин) + простые птериновые соединения. Применяется для изготовления ЛС:
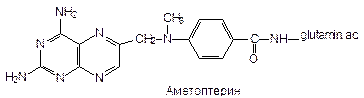
Метотрексат - угнетает редуктазу фолиевой к-ты, препятствует превращению фолиевой к-ты в кофермент - фолиновую к-ту Þ угнетает синтез НК. По свойствам близко к фолиевой к-те.
К.О.: ХроматоСФМ - отделяют от фолиевой к-ты на бумаге. Элюат - 0,1н щелочь. Метотрексат - не менее 85%. Определяют в УФ.
ЛФ: Таблетки в оболочке, порошок в ампулах. Список Б.
Хранение: при температуре не более 10оС.
Это цитостатик - внутрь, в/м, в/в. Токсичен. При попадании на кожу смывают содой.
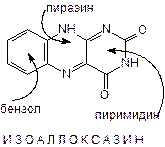 |
