Тұнбаны еріту жағдайлары және ерігіштікке
Сер ететін факторлар
Тұнбаны еріту үшін ерітіндідегі оның құрамына кіретін иондардың көбейтіндісі (ИК) ерігіштік көбейтіндісінен кем болуы керек ИК<EK. Бұл жағдайда қанықпаған ерітінді пайда болады, тепе-теңдік тұнбаның еру жағына қарай ығысады. Тұнбаның еруі тепе теңдік орнағанша (ИК=ЕК), яғни қаныққан ерітінді пайда болғанша жүреді. Ол үшін тұнбаның қаныққан ерітіндісіндегі иондардың концентрацияларын кеміту қажет. Иондардың концентрацияларын кемітуде бәсекелес реакциялардың маңызы зор. Басекелес реакциялар: 1) тұнбаның иондарын газ бөліп ыдырайтын қосылысқа айналдыру; Мысалы,
СаСО3+2НCl↔Ca2++2Cl-+H2CO3, H2CO3↔H2O+CO2↑.
Карбонаттар күшті қышқылдармен қатар әлсіз сірке қышқылында да ериді:
МСО3↓+2СН3СООН→М2+ + 2СН3СОО- + Н2О +СО2↑.
Карбонаттарды қышқылмен әрекеттестіргенде карбонат иондары әлсіз және тұрақсыз көмір қышқылына айналғандықтан ерітіндідегі СО32- аниондарының концентрациясы азаяды, соның нәтижесінде тепе теңдік солдан оңға қарай ығысады, яғни тұнбаның ерігіштігі артады. Тұнбаны толық еріту үшін қышқылдың жеткілікті мөлшерін қосу керек: 2) тұнба иондарын суда жақсы еритін нашар ионизацияланатын қосылысқа көшіру (қышқыл-негіздік реакциялар); Мысалы, Mg(OH)2↓+2NH4+→ Mg2+ +2NH3∙H2O. Тұнбаның еру қабілеттігі оның ЕК мен пайда болған әлсіз электролиттің ионизациялану константасына байланысты:
І
Mg(OH)2↓ ↔ Mg2+ +2ОН-
+2NH4+
↕ІІ
2NH3∙H2O.
Келтірілген реакцияда екі тепе-теңдік орнайды, реакцияның қорытындысы ерітіндідегі жалпы тепе-теңдіктің мәніне байланысты. Бірінші тепе теңдік Mg(OH)2↓↔ Mg2+ +2ОН- ЕК (Mg(OH)2), ал екінші тепе – теңдік 2ОН-+2NH4+↔2NH3∙H2O (1/ К2 (NH3∙H2O)) константаларымен сипатталады. Жалпы тепе – теңдік әр тепе – теңдік константаларының көбейтіндісіне тең:
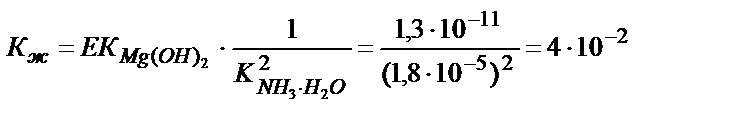
Егер жалпы тепе – теңдік константасының мәні бірден көп болса (Кж>1), реакция аяғына дейін жүреді, 1 мен 10-4 аралығында (Кж =1+10-4) болса, реакция аяғына дейін жүру үшін реактивтің артық мөлшерін құю қажет, ал 10-4-тен аз болса (Кж <10-4) реакция жүрмейді. Магний гидроксидінің аммоний тұздарында еру реакциясының тепе – теңдік константасы 1> Кж>10-4 аралығында болғандықтан тұнбаны толық еріту үшін аммоний тұздарының артық мөлшерін қосу қажет. Ерігіштік көбейтіндісі өте аз Fe(OH)3 аммоний тұздарында ерімейді: EK (Fe(OH)3) = 3,7∙10-40:
Fe(OH)3+3NH4+↔ Fe3++3NH3∙H2O
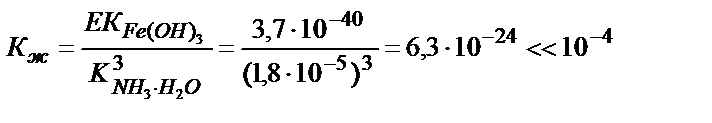
Fe(OH)3 қышқылдарда ериді:
Fe(OH)3+3H+↔ Fe3++3H2O
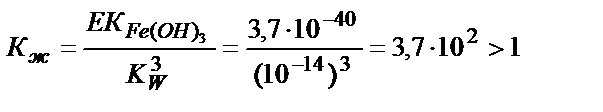
Егер тұнба әлсіз қышқылдың тұзы болса, мұндай тұздың ерігіштігі ерітіндінің қышқылдығына байланысты өзгереді. Мысалы:
FeS↓+2НCl↔Fe 2++2Cl-+H2S
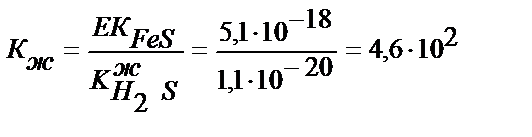 тұнба тұз қышқылында толық ериді.
тұнба тұз қышқылында толық ериді.
Тепе – теңдік константасының мәнінен тұнбаның әртүрлі рН ғы ерігіштігін табуға болады. Ол үшін пайда болған электролиттің ионизациялану константасымен қатар сол электролиттің құрамына кіретін бар бөлшектердің концентрациясын ескеретін бәсекелес реакцияның коэффициенті α мен шартты тепе – теңдік константасын пайдалану қажет.
Сульфид иондарының сутегі иондарымен сатылай байланысатынын еске алсақ:
FeS↓↔Fe 2++ S2-
+H3О+
↕
НS- +H2O+ H3О+® H2S +2H2O
Құрамында сульфид иондары бар бөлшектердің жалпы концентрациясы:
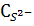 =[ S2-]+[ НS-]+[ H2S]
=[ S2-]+[ НS-]+[ H2S]
Конкурентті реакцияға S2- ионы қатысқандықтан α( S2-)<1. (5.40) теңдігінен
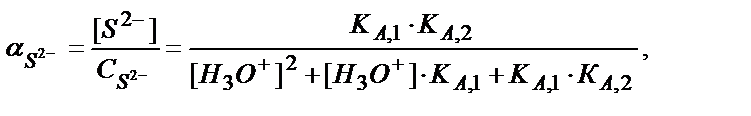
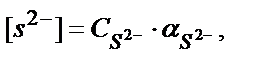 ЕК = [Fe2+]∙[ S2-] = [Fe2+]∙C S2- ∙ α S2-
ЕК = [Fe2+]∙[ S2-] = [Fe2+]∙C S2- ∙ α S2-
Тұнбаның молярлы ерігіштігі:
ε = [Fe2+] = 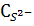 ; ЕК = ε2 ∙
; ЕК = ε2 ∙ 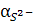
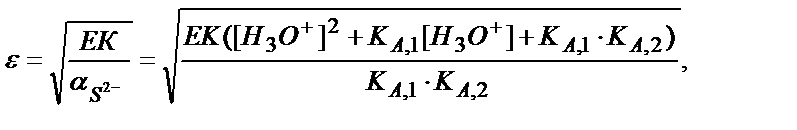
Мысалы, рН 3 және 9-ға тең ерітінділердегі FeS-тің ерігіштігін табайық:
a) pH=3: 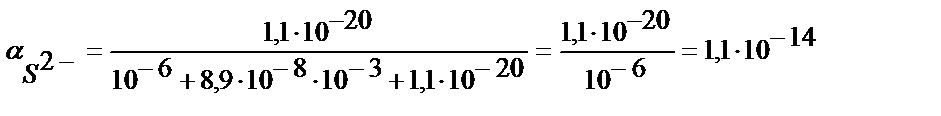
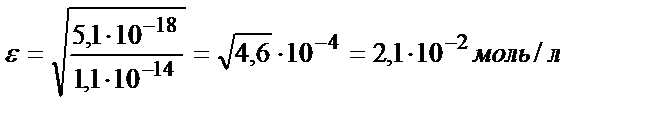
b) pH=9: 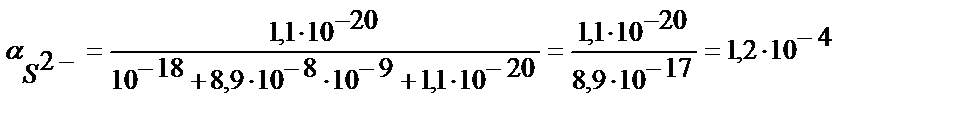
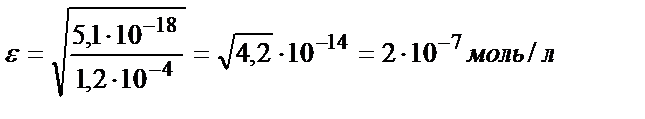
Келтірілген мысалдан ерітіндінің рН артқан сайын FeS-тің ерігіштік қабілеттігінің төмендейтінін көруге болады. Сол сияқты тұнбаның анионы әлсіз үш негізді қышқылдың ионы болса, тұздың ерігіштігі мынадай теңдікпен есептеледі:
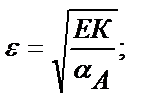
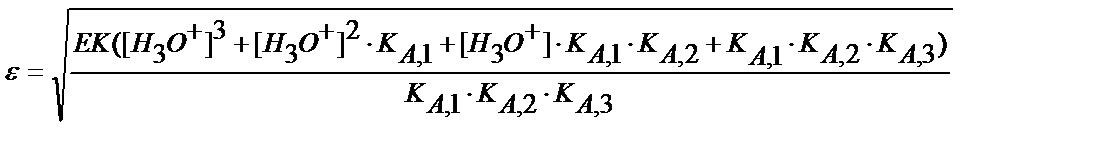
Мысалы, темір (ІІІ) фосфатының рН 2 ерітіндідегі ерігіштігін есептейік:
ЕК(FePO4) =1,3 ∙ 10-22, фосфор қышқылы үшін КА,1=7,6∙10-3; КА,2=6,2∙10-8, КА,3=4,4∙10-13.
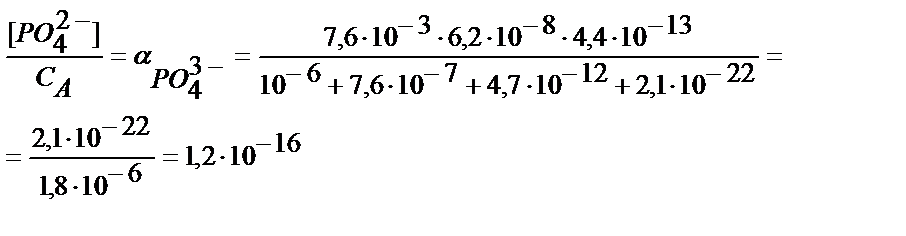
ЕК(FePO4)=[Fe3+]CA∙α(PO43-); 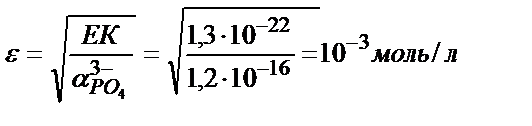
Ал ерітіндінің иондық күшін еске алса
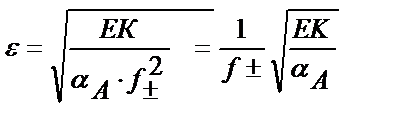
3) Тұнба иондарын тотықтырып, не тотықсыздандырып басқа қосылысқа айналдыру. Көптеген сульфидтер тұз қышқылында ерімейді, себебі олардың ЕК өте аз болғандықтан тұнбаның еруі нәтижесінде пайда болған S2- аниондары сутегі иондарымен байланыспайды. Мысалы, CuS + 2HCl ≠CuCl2 + H2S. Сондықтан оларды еріту үшін тотықтыру реакциясы пайдаланылады:
3CuS↓+8HNO3 → 3Cu (NO3)2 + 3S↓+ 2NO + 4H2O
CuS↓-2e → Cu2 + + So | 3
NO3- + 4H+ + 3e → NO +2H2O | 2
I
CuS↓-2e ↔Cu2 ++ S2-
+
HNO3
↕ II
So ↓ + NO +2H2O
Тұнбаның құрамына кіретін S2- анионы тотығып бос күйіндегі күкіртке айналуы нәтижесінде ІІ тепе-теңдік, соған байланысты І тепе – теңдік те солдан оңға қарай ығысады. Азот қышқылы жеткілікті мөлшерде болғанда сульфид түгел еріп кетеді.
Ерігіштік көбейтіндісі 10 -52 тең HgS азот қышқылында да нашар ериді, оны толық еріту үшін күшті тотықтырғыш – патша сұйығы (3 көлем концентрлі HCl және 1 көлем концентрлі HNO3) пайдаланылады:
3HgS↓ + 2HNO3 + 12HCl → 3H2[HgCl4] + 3S↓ + 2NO + 4H2O
Патша сұйығы тотықтырғыш қасиетінен басқа сынап(ІІ) иондарын комплекстік иондарға [HgCl4]2- ауыстырады. Тұнбаның құрамындағы екі ион да басқа тұрақты қосылысқа айналғандықтан тепе-теңдік тұнбаның еру жағына қарай ығысады.
4) Тұнба иондарын комплекстік қосылысқа айналдыру. Тұнбаның құрамына кіретін бір ионмен тұрақты комплекс түзетін зат сол ионның ерітіндідегі концентрациясын азайтып, тұнбаның ерігіштігін арттырады. (αM < 1, αA = 1):
MA ↓↔ M + A 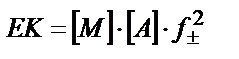
+L
↕ 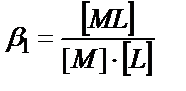 (11.13)
(11.13)
ML
+L ↕ 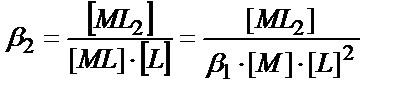 (11.13)
(11.13)
ML2
……………………………………………………………………
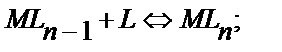
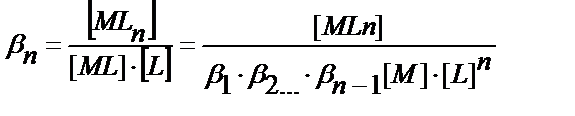 (11.14)
(11.14)
M мен A бір, екі, үш т.б. зарядталған иондар болуы мүмкін, ал L молекула не ион түрінде жүрген комплекстүзгіш.
Бәсекелес комплекс түзу реакциясының коэффициеті αM = [M] / CM табу қажет. Металл иондарының жалпы концентрациясы
CM = [M] + [ML] + [ML2] ……..[MLn] (11.15)
(11.12-11.14) теңдіктерінен комплекстік бөлшектерінің концентрацияларының мәндерін тауып (11.15) теңдікке қойсақ:
CM = [M] ∙(1+β1∙[L] + β1 ∙β2 ∙[L]2 …..+ β1 ∙β2….∙βn ∙[L]n ;
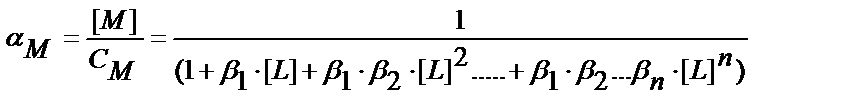
ЕК= [M] ∙[A] = αM∙CM∙[A] ; ε = CM∙[A] ; ЕК= αM ∙ ε2 ; ε2 = ЕК / αM ;
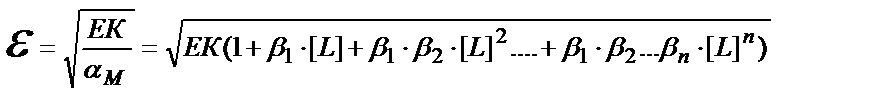
Мысалы, күміс иодидінің 0,1 M аммиак ерітіндісіндегі ерігіштігін есептейік. EK AgJ = 9 ∙10-17, күмістің аммиакты комплекстерінің сатылай түзілу константалары: β1= 1,6 ∙ 10 3 ; β2 =6,3∙103.
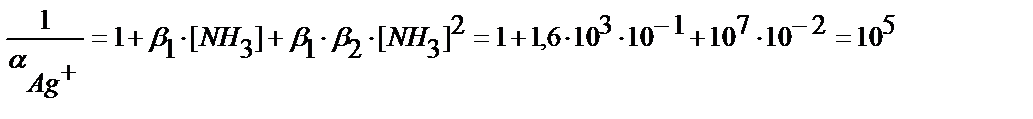
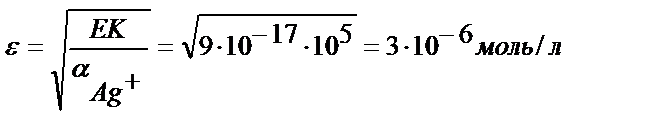
Іс жүзінде бұл тұнбаның аммиактың судағы ерітіндісінде ерімейді деуге болады, ал EK = 1,8 ∙10-10 тең AgCl тұнбасы үшін:
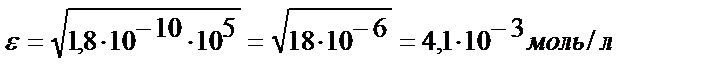 яғни ол аммиактың артық мөлшерінде ериді.
яғни ол аммиактың артық мөлшерінде ериді.
Егер тұнбаның ерігіштігі ерітіндіде жүрген металл иондарын байланыстыратын лигандтар мен аниондарды байланыстыратын сутегі иондарына тәуелді болса және ерітіндінің иондық күшін ескеретін болсақ, тұнбаның ерігіштігін есептейтін теңдік былай жазылады:
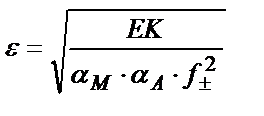
5) Күшті күкірт қышқылының нашар еритін тұздары CaSO4, SrSO4, BaSO4 қышқылдарда ерімейді. Сондықтан бұл тұнбаларды еріту үшін алдымен оларды қышқылдарда жақсы еритін карбонаттарға айналдырады.
EK (CaSO4)=2,5 10-5; EK (SrSO4) = 3,2 10-7; EK (BaSO4) = 1,1 10-10
EK (CaSO3)= 4,8 10 -9; EK (SrSO3)= 1,1 10-9 ; EK (BaSO3) = 5,1 10-9
Бір нашар еритін қосылысты екінші нашар еритін қосылысқа айналдыруға болатын-болмайтынын реакцияның тепе теңдік константасын есептеп анықтауға болады:
MSO4↓+CO32- ↔ MCO3↓ + SO42-
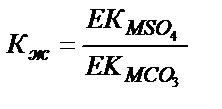
Мысалы, келтірілген сульфаттардың карбонаттарға ауысу мүмкіндігін қарастырсақ:
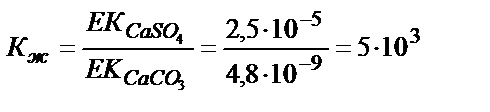
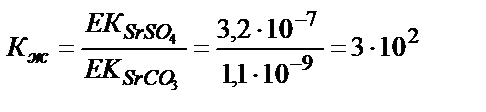
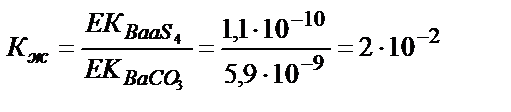
Кальций мен стронций сульфаттары карбонаттарға жеңіл ауысады, себебі алынған тұнбаның ЕК әрекеттестіретін тұнбаның ЕК-нен әлдеқайда аз, соған сәйкес тепе-теңдік константасының мәні үлкен. Барийға сәйкес тепе-теңдік константасының мәні 1>2∙10-2>10-4 болғандықтан бұл реакция жүру үшін реактивтің артық мөлшері қажет. BaCO3 тұнбасы түзілу үшін [Ba2+]∙[CO32-] > EK (BaCO3) болу керек, не [Ba2+] > EK (BaCO3) /[CO32-]. Бұл жағдайда барий иондарының концентрациясы BaSO4 тұнбасының ерігіштігімен анықталады: [Ba2+] = EK (BaSO4) /[SO42-]. Барий сульфаты барий карбонатына ауысу үшін мынадай жағдай болу керек:
EK (BaSO4) / [SO42-] > EK (BaCO3) / [CO32-]
Осыдан [CO32-]/[SO42-]>EK(BaCO3)/EK(BaSO4) 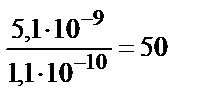
[CO32-] / [SO42-] > 50, яғни карбонат иондарының 50 еседен артық мөлшері қажет. Барий сульфатының карбонатқа ауысу реакциясының нәтижесінде:
ВаSO4↓+CO32- ↔ ВаCO3↓ + SO42-
Карбонат иондарының концентрациясы азаяды да, сульфат иондарының концентрациясы артады, екі ионның қатынасы 50-ге теңескенде тепе теңдік орнайды да, сульфаттың карбонатқа айналу реакциясы тоқтатылады. Ал егер тұнбаның үстіндегі ерітіндіні төгіп тастап, оны Nа2CO3 ерітіндісінің жаңа үлесімен әрекеттестірсе, онда карбонат түзілу реакциясы жаңадан басталады. Осы операцияны бірнеше рет қайталаса, ВаSO4 тұнбасын толық ВаCO3 -ке айналдыруға болады.
