Гальванический элемент Даниэля-Якоби
Гальванический элемент Даниэля-Якоби (рис. 7.1), который состоит из медной и цинковой пластинок, опущенных в растворы своих солей. На поверхности цинковой пластинки устанавливается равновесие
Zn 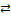 Zn2+ + 2ē,
Zn2+ + 2ē,
которому соответствует потенциал jZn. На поверхности медной пластинки устанавливается равновесие
Cu 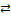 Cu2+ + 2ē,
Cu2+ + 2ē,
которому соответствует равновесный потенциал jСu.
Потенциал цинкового электрода имеет более отрицательное значение, поэтому при замыкании внешней цепи электроны будут переходить от цинка (анод) к меди (катод). В результате этого процесса равновесие на аноде (Zn) сместится вправо и в раствор перейдет дополнительное количество ионов цинка (происходит растворение анода). В то же время равновесие на медном электроде сместится влево и произойдет выделение меди на катоде.На аноде образуется избыток электронов, поэтому анод в гальванических элементах заряжен отрицательно, а катод – положительно.
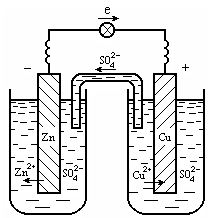
Рис. 7.1. Медно-цинковый гальванический элемент
Т.о. при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде.Электроны от анода по внешней цели протекают к катоду.Электрическую цепь замыкает движение ионов в растворах.
Схема гальванического элемента, заменяющая рисунок, записывается следующим образом:
Zn½Zn2+║Cu2+½Cu .
(А): Zn- 2ē = Zn2+,(окисление)
(К): Cu2+ + 2ē = Cu0,(восстановление)
Zn + Cu2+ = Zn2+ + Cu .
Суммарная реакция, протекающая в гальваническом элементе, называется токообразующей.
Причиной возникновения и протекания электрического тока в гальваническом элементе является разность электродных потенциалов (ЭДС) двух окислительно-восстановительных систем, соединенных между собой. ЭДС (ξ) любого гальванического элемента определяется общей формулой:

или
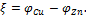
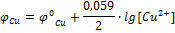
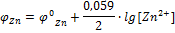
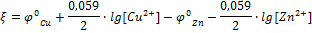
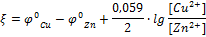
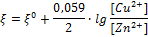
Так как ξ может иметь только положительное значение, то 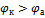 , т.е. катодом является электрод с более высоким электродным потенциалом.
, т.е. катодом является электрод с более высоким электродным потенциалом.
При таком осуществлении окислительно-восстановительной реакции ее энергия превращается в электрическую энергию, которую можно использовать, включив во внешнюю цель устройство, потребляющее электрическую энергию (например, электронагревательный прибор, электрическую лампу и т.п.).
С течением времени разность потенциалов будет снижаться, т.к. концентрация ионов цинка, а следовательно, и потенциал цинкового электрода будут увеличиваться, а концентрация ионов меди и потенциал медного электрода постепенно будут снижаться. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы электродов ( 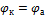 ) или не растворится весь цинк (высадится вся медь), т.е. пока ЭДС не станет равной нулю.
) или не растворится весь цинк (высадится вся медь), т.е. пока ЭДС не станет равной нулю.
Как уже было показано, электроды, а следовательно, и гальванические элементы могут быть созданы не только для реакции окисления-восстановления металлов, но и для любых веществ и окислительно-восстановительных реакций, происходящих в растворах или расплавах. Например, для реакции в растворе
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
процессы окисления и восстановления можно разделить в виде полуреакций :
на аноде: 5 ½SO32- + H20 = SO42- + 2H+ + 2ē; (0,17 В),
на катоде: 2 ½ MnO4- + 8H+ + 5e = Mn2+ + 4H2O (1,51 В).
2MnO4- + 5SO32- + 6H+ + 10ē = 2Mn2+ + 5SO42- + 3H2O + 10ē.
Токообразующая реакция:
2MnO4- + 5SO32- + 6H+ = 2Mn2+ + 5SO42- + 3H2O.
Для осуществления таких реакций обычно используют катализатор, который одновременно является проводником электронов, например платину (рис. 7.2).
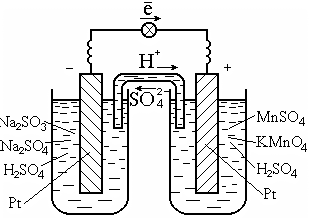
Рис. 7.2. Гальванический элемент на окислительно-восстановительной реакции в растворе
Схема гальванического элемента:
Pt | SO32-, SO42-, H+|| MnO4-, Mn2+, H+| Pt .
Значения стандартных электродных потенциалов полуреакций приводятся в справочниках. ЭДС такого элемента при стандартных условиях можно определить как разность потенциалов для полуреакций восстановления (окислителя) и окисления (восстановителя).
ξ = Dj0 = j0 (MnО4-/ Mn2+) -j0 (SO42- / SO32-) = 1,51 - 0,17 = 1,34 B.
Если при этом ЭДС положительна, то реакция возможна при стандартных условиях, так как DG реакции и электрическая работа (ЭДС) связаны между собой соотношением:
DG = -n·F·ξ.
Таким образом, разность потенциалов на электродах можно не только непосредственно измерить, но и вычислить из чисто химических экспериментальных данных. В случае нестандартных условий потенциал электрода и ЭДС элемента рассчитывается по формуле Нернста.
