Химического равновесия
Пример 5. какими изменениями концентрации веществ можно повысить выход водорода в реакции
СН4 + СО2 Û 2СО + 2Н2
Решение. Для повышения выхода водорода необходимо сместить равновесие вправо, то есть заставить ускоренно протекать прямую реакцию. По закону действия масс, скорость реакции прямо зависит от концентрации реагирующих веществ. Следовательно, для повышения выхода водорода нужно увеличить концентрацию метана СН4или диоксида углерода СО2 ,или обоих веществ вместе.
С другой стороны, можно замедлить обратную реакцию, которая расходует образующийся водород, а замедление реакции связано с уменьшением концентраций реагирующих веществ, следовательно, чтобы повысить выход водорода, нужно уменьшить концентрацию оксида углерода СО или отводить из равновесной системы получающийся водородН2, тогда система будет стремиться повысить его выход.
Таким образом, согласно принципу Ле-Шателье, увеличение концентрации веществ смещает равновесие в сторону той реакции, которая уменьшает их концентрацию, а уменьшение концентраций веществ смещает равновесие в сторону той реакции, которая их пополняет, увеличивает концентрацию. В данном случае константа равновесия 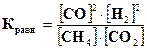 не изменится, т.к. согласно закону сохранения масс веществ увеличение концентрации одних веществ (например, СН4иСО2)вызывает увеличение во столько же раз концентрации других веществ (СОиН2).В результате величина дроби не изменится, т.е. константа равновесия не зависит от концентрации.
не изменится, т.к. согласно закону сохранения масс веществ увеличение концентрации одних веществ (например, СН4иСО2)вызывает увеличение во столько же раз концентрации других веществ (СОиН2).В результате величина дроби не изменится, т.е. константа равновесия не зависит от концентрации.
Зная это, можно на основании выражения константы равновесия сделать вывод о направлении смешения равновесия при изменении концентрации веществ. Например, в данном случае уменьшение концентрации СО вызовет уменьшение числителя дроби. Чтобы дробь осталась неизменной, должен уменьшиться знаменатель, т.е. уменьшиться концентрация СН4иСО2, что соответствует ускорению прямой реакции и смещению равновесия вправо.
