Возникновение физической химии. М. В. Ломоносов.
Й час
Физи́ческая хи́мия— наука об общих законах физики и химии. Исследует химические явления с помощью теоретических и экспериментальных методов химии и физики.
Предмет изучения физической химии
Физическая химия является основным теоретическим фундаментом современной химии, использующим теоретические методы таких важнейших разделов физики, как квантовая механика, статистическая физика и термодинамика, нелинейная динамика, теория поля и др. Она включает учение о строении вещества, в том числе: о строении молекул, химическую термодинамику, химическую кинетику и катализ. В качестве отдельных разделов в физической химии выделяют также электрохимию, фотохимию, физическую химию поверхностных явлений (в том числе адсорбцию), радиационную химию, учение о коррозии металлов, физико-химию высокомолекулярных соединений и др. Весьма близко примыкают к физической химии и подчас рассматриваются как её самостоятельные разделы коллоидная химия, физико-химический анализ и квантовая химия. Большинство разделов физической химии имеет достаточно чёткие границы по объектам и методам исследования, по методологическим особенностям и используемому аппарату.
Различие между физической химией и химической физикой
Обе эти науки находятся на стыке между химией и физикой, иногда химическую физику включают в состав физической химии. Провести чёткую границу между этими науками не всегда возможно. Однако с достаточной степенью точности это отличие можно определить следующим образом:
· физическая химия рассматривает суммарно процессы, протекающие с одновременным участием множества частиц;
· химическая физика рассматривает отдельные частицы и взаимодействие между ними, то есть конкретные атомы и молекулы (таким образом, в ней нет места понятию «идеальный газ», которое широко используется в физхимии).
История физической химии
Возникновение физической химии. М. В. Ломоносов.
История развития науки показывает, что сочетание методов (и выводов) двух научных дисциплин часто бывает весьма плодотворным, в особенности при исследовании вопросов, относящихся к промежуточной области. Физическая химия возникла и развивалась в первое время на основе применения физических методов исследования и физических теорий для изучения химических свойств веществ и химических процессов, а также изучения влияния химического состава веществ, их строения и условий существования на их физические свойства. Впоследствии, обладая уже обширным фондом новых экспериментальных данных и развивая собственные теоретические обобщения и выводы, физическая химия продолжала успешно использовать вместе с тем и экспериментальные данные, методы эксперимента и теоретические выводы и физики, и химии.
Возникновение физической химии относится к середине XVIII в. — к тому периоду, когда развитие знаний в области физики и химии создало основу для выделения и дальнейшего развития физической химии как самостоятельной научной дисциплины. Первый в мире курс физической химии был создан нашим великим соотечественником Михаилом Васильевичем Ломоносовым (1711 —1765) на основе успешно проведенных им многочисленных физико-химических исследований.
Само определение химии как науки о качествах и изменениях тел, данное Ломоносовым (1741), принципиально отличалось от принятых в то время определений химии как науки о свойствах тел. Здесь, как и в других вопросах, Ломоносов подчеркивал значение изменения, т. е. движения материи.
Вместе с тем, рассматривая процессы движения, он указывал, что «никакое движение в природе не может происходить без материи» (1744).
Огромной заслугой Ломоносова было то, что он первый количественно обосновал основной закон химических превращений — закон сохранения массы вещества. Уже тогда Ломоносов подошел к обобщенному определению принципа сохранения материи и движения, получившего ныне всестороннее доказательство и признание как всеобщего закона природы. Впервые Ломоносов формулировал этот закон в 1748 г.
Огромное влияние на формирование правильных представлений о природе химической валентности и химическом строении вещества оказали работы Александра Михайловича Бутлерова (1828—1886). Он является создателем теории химического строения (1861), на основе которой развилась современная органическая химия. Его теория строения приводит к химическим формулам, отражающим относительное расположение и взаимосвязь атомов в молекулах данного соединения. Эта теория позволяет установить взаимное влияние атомов в молекуле, в том числе и тех, которые связаны между собой не непосредственно, а через другие атомы.
Для развития физической химии, как и вообще всей химии, огромное значение имели работы Дмитрия Ивановича Менделеева (1834—1907) и прежде всего открытие им знаменитого периодического закона (1869), впервые показавшего единство природы различных химических элементов. Этот закон дал возможность, пользуясь экспериментальными данными о свойствах одних элементов и их соединений, предвидеть эти свойства для других элементов и соединений.
Физическая химия занимается рассмотрением главным образом двух групп вопросов:
1. Изучением свойств и строения различных веществ (а также частиц, из которых они состоят — молекул, атомов и ионов) в зависимости от их химического состава и химического строения и условий существования.
2. Изучением химических реакций и других форм взаимодействия между веществами или частицами (направление, скорость, молекулярный механизм и термодинамические параметры процесса) в зависимости от их химического состава и строения и от условий, в которых происходит процесс, а также от внешних воздействий — электрических, световых и др.
Содержание курса физической химии обычно делят на несколько основных разделов, характеризующих направление этой науки и определяющих ее предмет. Важнейшие из этих разделов охватывают ряд вопросов.
Строение вещества. В этот раздел входит учение о строении атомов и молекул и учение об агрегатных состояниях вещества. Учение о строении атома, относящееся в большей степени к физике, в курсах физической химии необходимо для выяснения вопросов образования молекул из атомов, природы химической связи, внутренней структуры молекул. В учении об агрегатных состояниях рассматривается зависимость строения и важнейших свойств веществ, находящихся в газообразном, кристаллическом и жидком состояниях, от их состава.
Химическая термодинамика базируется на двух основных законах термодинамики. В этом разделе физической химии рассматриваются основные соотношения, вытекающие из первого закона, которые позволяют определить тепловой и общий энергетический балансы химических процессов, рассчитать количества выделяемой или поглощаемой теплоты и определить, как будет влиять на процесс изменение внешних условий. На основе второго закона определяется возможность самопроизвольного течения процесса в интересующем нас направлении, а также условия-равновесия и его смещения под влиянием изменения внешних условий.
Учение о растворах рассматривает природу растворов, их внутреннюю структуру и важнейшие свойства, зависимость свойств растворов от концентрации и химической природы компонентов и вопросы растворимости.
Электрохимия изучает некоторые особенности свойств растворов электролитов, электропроводность растворов, процессы электролиза, работу гальванических элементов и электрохимическую коррозию металлов.
Химическая кинетика изучает скорость и молекулярный механизм химических реакций как в гомогенной, так и в гетерогенной среде, включая и явления катализа.
Изучение поверхностных явлений и свойств коллоидных систем выделяют в самостоятельную группу вопросов физической химии.
Такое деление всегда в известном смысле условно, так как реальный процесс обычно связан с различными явлениями. Ни одно явление в природе не может быть понято, если взять его в изолированном виде, вне связи с окружающими явлениями. Наоборот, любое явление может быть понято и обосновано, если оно рассматривается в его неразрывной связи с окружающими явлениями.
Законы, рассматриваемые в физической химии (как и другие законы естествознания), имеют характер объективных законов, описывающих явление. По мере развития науки открываются новые, неизвестные ранее законы; более точно определяются пределы применимости ранее открытых законов в различных условиях и пр. Любой из рассматриваемых нами законов только с той или другой степенью точности отражает явление, а не «управляет» им.
Разделы физической химии
· Учение о строении вещества, свойствах молекул, ионов, радикалов, природе химической связи — В этот раздел входит учение о строении атомов и молекул и учение об агрегатных состояниях вещества. Учение о строении атома, относящееся в большей степени к физике, в курсах физической химии необходимо для выяснения вопросов образования молекул из атомов, природы химической связи.
· Химическая термодинамика — В этом разделе физической химии рассматриваются основные соотношения, вытекающие из первого закона термодинамики, которые позволяют рассчитать количество выделяемой или поглощаемой теплоты и определить, как будет влиять на него изменение внешних условий. На основе второго закона термодинамики определяется возможность самопроизвольного течения процесса, а также условия положения равновесия и его смещения под влиянием изменения внешних условий. Внутри данного раздела можно выделить несколько подразделов:
o Термодинамика газов
o Термодинамика растворов рассматривает природу растворов, их внутреннюю структуру и важнейшие свойства, зависимость свойств от концентрации и химической природы компонентов и вопросы растворимости.
o Термодинамика адсорбции
o Статистическая термодинамика позволяет получать термодинамические параметры системы исходя из строения компонентов системы и внешних условий.
· Химическая кинетика — изучает скорость химических реакций, её зависимость от внешних условий (температура, концентрации). Является одним из важнейших разделов химии, показывает какой именно продукт образуется в сложной системе
· Электрохимия изучает некоторые особенности свойств растворов электролитов, электропроводность растворов, процессы электролиза)
· Звукохимия (акустохимия) изучает химические процессы, протекающие при действии звуковых волн.
· Потенциометрия — междисциплинарная область физической химии, подразумевающая использование различных электрохимических и термодинамических методов, методов аналитической химии, — широко применяемых в научных исследованиях различной принадлежности, — в производственной практике; в том числе — ионометрии, pH-метрии, а также при создании измерительной аппаратуры используемой в них
Коллоидная химия
Колло́идная хи́мия (др.-греч. κόλλα — клей) — традиционное название физической химии дисперсных систем и поверхностных явлений, возникающих на границе раздела фаз.
Современная коллоидная химия— это наука «на стыке» химии, физики, биологии. Особое междисциплинарное положение коллоидной химии подчёркивается тем, что в зарубежной литературе часто используют название «коллоидная наука».
Коллоидная химия — наука о дисперсных системах и поверхностных явлениях. Изучает адгезию, адсорбцию, смачивание, коагуляцию, электрофорез. Разрабатывает технологии строительных материалов, бурения горных пород, зол-гель технологии. Играет фундаментальную роль в нанотехнологии.
Коллоидная химия как наука имеет небольшую историю, однако свойства коллоидных систем и коллоидно-химические процессы человек использовал с давних времён. Это, например, такие ремёсла, как получение красок, керамики, глазури, прядение льна, хлопка, шерсти, выделывание кож.
Основоположником коллоидной химии принято считать Т. Грэма, выполнившего в 60-х годах XIX века первые систематические исследования коллоидных систем (золей). Ему же принадлежит и введение термина «коллоид». Впоследствии коллоидная химия включила в себя результаты, полученные в других областях физики и химии, и в конце XIX — начале XX веков сформировалась в самостоятельный раздел химии.
2-й час……………………………………………………
СТРОЕНИЕ АТОМА
Атомно-молекулярное учение.Представление об атомах как о мельчайших неделимых уже дальше частицах, из которых состоят все вещества, возникло и сформировалось впервые в V в. до нашей эры в трудах древнегреческих философов Левкиппа, Демокрита и позднее Эпикура и др. Это представление было чисто умозрительным, не основанным на опытных данных. В дальнейшем оно было надолго вытеснено возникшим примерно в ту же эпоху учением Аристотеля об элементах. Длительному господству учения Аристотеля в немалой степени способствовало то, что оно было возведено в догмат католической церковью, которая всякие попытки возродить атомистические представления подавляла как еретические. Лишь в XVI в. с учением об атомах открыто выступил Джордано Бруно. В 1626 г. парижский парламент декретировал запрещение (под страхом смертной казни) заниматься корпускулярной теорией, как тогда называлось атомное учение. Однако, учение об атомах как научная гипотеза уже разрабатывалось в XVII в. Декартом, Гассенди, Ньютоном и другими учеными.
Дальнейшее значительное развитие атомное учение получило в работах М. В. Ломоносова, который считал атом не просто мельчайшей частицей, а частицей, обладающей определенными (для данного элемента) химическими свойствами. Он впервые указал на различие между атомами и молекулами и рассматривал молекулы как мельчайшие частицы данного вещества, обладающие тем же составом, что и вещество в целом. Ломоносов считал, что молекулы данного вещества одинаковы и состоят из одинакового числа соответствующих атомов, взаимно соединенных между собой одинаковым образом. Его работы в области атомно-молекулярного учения не были приняты учеными того времени, но нашли блестящее подтверждение в последующем развитии науки.
В первый период развития атомно-молекулярной теории основные положения ее в сущности мало отличались от взглядов, высказанных Ломоносовым.
Развитие количественных методов исследования в химии связано с определением относительных масс атомов и молекул и введением величин грамм-атома и грамм-молекулы (моля). В настоящее время термину «моль» присвоено более широкое содержание. Он охватывает теперь понятия грамм-молекулы, грамм-атома, грамм-иона, грамм-радикала, грамм-эквивалента и др.
Согласно решениям соответствующих международных организаций величина моль может быть определена следующим образом.
Моль — это такое количество вещества или частиц данного вида, которое содержит столько же частиц данного вида, сколько атомов содержится в 0,012 кг изотопа углерода 12С.
Вводится следующее различие в употреблении понятий «масса» и «.количество» вещества.
Масса вещества выражается числом килограммов (или граммов и пр.), а количество вещества или частиц выражается числом молей (или киломолей и пр.).
Атом водорода.Первая количественная теория атома была разработана Бором для наиболее простого из атомов — атома водорода. В 1913 г. он опубликовал результаты теоретического расчета модели атома водорода, прекрасно подтверждающиеся экспериментальными данными о спектре водорода. Теория эта основывалась на некоторых допущениях (постулатах), которые нельзя было тогда доказать, но правильность их подтверждалась данными опыта. Позднее в несколько другой интерпретации эти постулаты получили обоснование в выводах квантовой механики. Указанные постулаты могут быть сведены к следующему:
1. Электрон может вращаться не по любым орбитам, а только по орбитам с определенными радиусами, отвечающим возможным значениям энергии атома.
2. При вращении по таким орбитам электрон не излучает энергии и атом находится в стационарном (т. е. неизменяющемся вовремени) состоянии. Излучение или поглощение энергии атомомпроисходит только при переходе электрона с одной орбиты надругую.
Так как электрон притягивается ядром, то переход на орбиту с меньшим радиусом сопровождается выделением некоторого количества энергии, а переход на орбиту с большим радиусом может происходить только при поглощении атомом соответствующего количества энергии.
3. Энергия, выделяющаяся или поглощаемая при переходе электрона с одной орбиты на другую, равна разности между количеством энергии электрона в начальном и конечном состояниях.
Выделение или поглощение энергии при переходах электронов может происходить только в форме монохроматических электромагнитных колебаний, т. е. электромагнитных колебаний, обладающих определенной для данного сочетания орбит длиной волны λ.
Частота электромагнитных колебаний ν, поглощаемых или излучаемых атомами при таких переходах электронов, пропорциональна изменению энергии ∆Е атома, причем коэффициент пропорциональности является универсальной постоянной — одной из основных постоянных современной физики. Он получил название элементарного кванта действия (постоянной Планка}., обозначается через hи равен 6,6256-10~27 эрг-с.
Обозначим через Е1 и Е2 энергию до и после рассматриваемого перехода электрона и через ∆Е их разность. Тогда допущение о монохроматичности колебаний можно выразить равенством
∆Е = Е1 — Е2 = hν (1,1)
которое называется условием частот.
Частота колебаний ν = с/λ, где с — скорость света в пустоте равная 3•1010 см/с (точнее, 2,997925-1010 см/с).
Кроме частоты колебаний ν (для характеристики) электромагнитных колебаний применяют другую величину ν', называемую волновым числом. Частота колебании ν равна числу колебаний в единицу времени (в 1 с), а волновоечисло ν ' равно числу колебаний на единицу пути (в единицах СИ — на 1 м). Они связаны равенством ν = cν1. Иначе говоря, ν' = 1/λ. В этих равенствах все величины должны выражены в одной системе единиц.
Глаз человека воспринимает только очень малую часть всего спектра. Так называемый видимый свет охватывает колебания с длинами волн от 3960 до 7600 А (ангстрем). За пределами его в области колебаний меньшей частоты располагаются инфракрасные лучи с длиной волн до десятых долей миллиметра, переходящие в радиоволны, применяемые в радиовещании; длина радиоволн измеряется уже сантиметрами, метрами, сотнями и тысячами метров. Первоначально радиоволны не находили непосредственного применения при исследовании строения атомов и молекул, но в настоящее время радиоспектроскопия все шире начинает использоваться, в особенности микроволновая спектроскопия.
В области колебаний меньшей длины волны, чем колебания видимого света, располагаются сначала ультрафиолетовые лучи с длинами волн примерно до 100 А, затем рентгеновские лучи — до 0,1 А и еще дальше -γ-лучи, излучаемые при радиоактивных превращениях и других процессах, протекающих в атомных ядрах.
Энергия электромагнитных колебаний прямо пропорциональна их частоте. Поэтому чем меньше длина волны колебаний, тем больше их энергия. Для видимой части спектра это проявляется в более сильном химическом действии фиолетовой части спектра по сравнению с красной. Этим различиям в энергии соответствует и различие в происхождении колебаний разных областей спектра и в характере действия их.
Химическая связь.
Химическая связь образуется в большинстве случаев в результате той или иной перегруппировки электронов, содержащихся во взаимодействующих атомах. Важнейшими формами таких перегруппировок являются: 1) передача одного или большего числа электронов от одного из атомов другому и 2) смещение электронов в направлении к одному из атомов, причем большей частью при этом образуются электронные пары, общие для взаимодействующих атомов и связывающие их между собой. В этих процессах основную роль играет относительная прочность связей электронов с разными атомами и способность последних к присоединению новых электронов. Вследствие этого необходимо ввести две новые величины, играющие большую роль при рассмотрении взаимодействия атомов: сродство атома к электрону и электроотрицательность элемента.
Образование химической связи. Ковалентная связь. Прежде чем перейти к рассмотрению отдельных видов связи, полезно сопоставить основные схемы их образования.
Схему образования типичной ионной связи можно представить следующим образом. Один из взаимодействующих атомов передает другому (или другим) один или большее число электронов, в результате чего атомы превращаются в ионы и эти ионы, притягиваясь друг к другу вследствие противоположного знака их заряда, образуют молекулу (или кристалл или вообще данное соединение).
Ковалентная связь образуется путем передачи каждым из взаимодействующих атомов одного (или большего числа) электрона на образование электронной пары (или пар), общей для обоих атомов, которой и осуществляется связь между ними.
Ионная связь в чистом виде может образоваться только между атомами элементов, сильно различающихся по своей электроотрицательности, а типичная ковалентная связь (неполярная) образуется, когда взаимодействующие атомы принадлежат элементам, одинаковым или почти одинаковым в этом отношении. В остальных случаях электронная пара, связывающая атомы, будет принадлежать им не в одинаковой степени. Она будет в той или иной степени как бы смещенной к одному из них или, точнее говоря, электроны этой пары в среднем во времени будут больше принадлежать одному из атомов, чем другому, т. е. больше времени находиться вблизи одного из них. Образующаяся в этом случае связь является полярной.
Так как при образовании ионной связи, присоединяемый атомом электрон обычно тоже образует электронную пару с неспаренным электроном данного атома, то можно сказать, что химическая связь большей частью осуществляется образованием электронной пары. В зависимости от соотношения электроотрицательностей элементов электронная пара может или полностью находиться у одного из них (ионная связь), или принадлежать им в одинаковой степени (типично или чисто ковалентная связь), или находиться в промежуточном состоянии (полярная связь).
Свободные атомы могут соединяться с образованием устойчивой молекулы только в тех случаях, когда процесс этот сопровождается выделением энергии. Именно выделение энергии и делает образующуюся молекулу устойчивой, так как для обратного разложения ее требуется затрата энергии извне. Из различных форм связи между атомами более устойчивой является обычно та, образование которой сопровождается выделением большего количества энергии.
Остановимся предварительно на некоторых отличиях в свойствах, присущих положительному водородному иону Н+. Водородный атом обладает той особенностью, отличающей его от всех остальных атомов, что, отдавая свой электрон, он остается в виде ядра без электронов, т. е. в виде частицы, диаметр которой в тысячи раз меньше диаметров остальных атомов. Кроме того, вследствие отсутствия у него электронов ион Н+ не испытывает отталкивания от электронной оболочки другого атома или иона, а наоборот, притягивается ею. Это позволяет ему ближе подходить к другим атомам и вступать во взаимодействие с их электронами (и даже внедряться в их электронную оболочку). Поэтому в жидкостях водородный ион Н+ большей частью не сохраняется в виде самостоятельной частицы, а связывается с молекулами других веществ. В воде он связывается с молекулами Н2О, образуя ион Н3О+, называемый ионом гидроксония; с молекулой аммиака он связывается, образуя ион NН4 — ион аммония, и т. д.
Перейдем теперь к вопросу о водородной связи. В различных состояниях водородного атома такая способность к присоединению может быть свойственна ему не в одинаковой степени. Наиболее сильной она будет тогда, когда он в наиболее полной степени отдает свой электрон, т. е. прежде всего, когда он находится в состоянии положительного иона Н+, а также, когда он связан с атомами наиболее электроотрицательных элементов — в первую очередь с атомами фтора и кислорода и в меньшей степени с атомами хлора и азота. Наоборот, в случае неполярной или малополярной связи (с углеродом, кремнием или другими) и тем более в случае связи с менее электроотрицательными элементами — с металлами (гидриды металлов)— этой способности у атома водорода быть не может.
Водородная связь — это как бы вторая (побочная) валентность водородного атома, которую он может проявлять по отношению к сильно отрицательным (в рассматриваемом состоянии) атомам, если основная валентность связывает его с атомом, тоже сильно отрицательным в данной молекуле. В состояниях, когда эта способность развита в сильной степени, атом водорода может настолько интенсивно взаимодействовать с электронами другого атома, что между ними устанавливается довольно прочная связь (с энергией связи большей частью 5— 7 ккал/моль), которая может хорошо проявляться в спектрах. Однако она все же много слабее обычной химической связи (энергия которой составляет примерно 30—100 ккал/моль).
Водородная связь возникает в результате междипольного взаимодействия двух сильнополярных связей, принадлежащих различным молекулам (или одной и той же молекуле), но она в значительной степени усиливается вследствие взаимной поляризации связей, обусловленной указанными особенностями водородного атома.
Вода. Водородная связь.
Этот удивительный факт пока не нашел однозначного объяснения. Безусловно, вода играет огромную роль в возникновении и существовании жизни на нашей планете. Прежде всего, нужно разобраться, почему вода может находиться в жидком и даже в твердом состоянии (лед) в условиях, в которых похожие соединения водорода с более тяжелыми элементами (серой, селеном и т.д.) газообразны.
Молекула воды имеет следующее строение:

Две поделенные электронные пары участвуют в образовании двух полярных ковалентных связей, а оставшиеся две неподеленные пары электронов тоже играют важную роль в свойствах воды. Все заместители у атома кислорода, включая неподеленные пары, стремятся расположиться как можно дальше друг от друга. Это приводит к тому, что молекула приобретает форму искаженного тетраэдра с атомом кислорода в центре. В четырех вершинах этого "тетраэдра" находятся два атома водорода и две неподеленные пары электронов. Но если смотреть только по центрам атомов, то получается, что молекула воды имеет угловое строение, причем угол Н–О–Н составляет примерно 105 градусов.
Для возникновения водородных связей важно, чтобы в молекулах вещества были атомы водорода, связанные с небольшими, но электроотрицательными атомами, например: O, N, F. Это создает заметный частичный положительный заряд на атомах водорода. С другой стороны, важно, чтобы у электроотрицательных атомов были неподеленные электронные пары. Когда обедненный электронами атом водорода одной молекулы (акцептор) взаимодействует с неподеленной электронной парой на атоме N, O или F другой молекулы (донор), то возникает связь, похожая на полярную ковалентную.

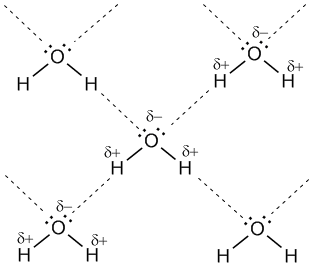
Рис. 7-1а. Водородные связи между молекулами воды (обозначены пунктиром).
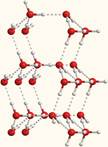
. 7-1б. Объемная модель, показывающая расположение молекул воды, связанных водородными связями.
Энергия водородной связи Н---О в димере воды (H2O)2 составляет 21,5 кДж/моль, а ее длина 2,04 А. Таким образом, эти связи более длинные и примерно в 10-20 раз менее прочные, чем обычные ковалентные, но именно они заставляют воду быть жидкостью или льдом (а не газом) в обычных условиях. Водородные связи разрушаются только тогда, когда жидкая вода переходит в пар.
При температурах выше 0°С (но ниже температуры кипения) вода уже не имеет такую упорядоченную межмолекулярную структуру, как показано на рисунках 7-1а и 7-1б. Поэтому в жидкой воде молекулы связаны между собой лишь в отдельные агрегаты из нескольких молекул. Эти агрегаты могут свободно двигаться рядом друг с другом, образуя подвижную жидкость. Но при понижении температуры упорядоченность становится все больше и больше, а агрегаты – все крупнее. Наконец, образуется лед, который имеет примерно такую упорядоченную структуру, как на рис. 7-1б и 3-15 из §3.8.
Кстати, на этих рисунках хорошо видно, что в кристалле льда между молекулами остаются пустоты. Объем пустот чуть больше, чем размер отдельной молекулы Н2О. Поэтому лед имеет меньшую плотность, чем жидкая вода и плавает на поверхности. Большинство же других веществ, при замерзании, увеличивает свою плотность.
Таким образом, водородные связи придают воде еще одно уникальное свойство, без которого вряд ли могла бы существовать разнообразная жизнь в тех районах Земли, где температура зимой понижается ниже 0°С. Если бы лед тонул в воде, то зимой все водоемы промерзали бы до самого дна. Трудно ожидать, что рыбы согласились бы жить в таких условиях. Человек мог бы растапливать лед, превращая его в воду для своих нужд, но это потребовало бы огромных затрат дополнительной энергии.
РАСТВОРЫ
Введение. Способы выражения состава растворов.
Растворами называются такие системы, в которых одно вещество равномерно распределено в среде другого или других веществ. В общем случае этот термин может относиться к любому агрегатному состоянию системы. Сюда входят и смеси газов, и жидкие растворы, и твердые растворы или смешанные кристаллы.
Процесс растворения в общем случае отнюдь не представляет собой простого распределения молекул или ионов одного вещества среди молекул или ионов другого, но большей частью связан с различными взаимодействиями химического и физического характера между ними.
Когда речь идет о жидких растворах, то нередко пользуются понятиями растворителя и растворенного вещества. В случае растворов газов или твердых веществ в жидкостях растворителем считается обычно жидкость, а растворенным веществом— растворенный газ или твердое вещество, независимо от их относительного количественного содержания. В случае же растворов, жидкостей в жидкостях применение этих понятий не всегда целесообразно.
Когда компоненты обладают ограниченной смешиваемостью, то растворителем является тот из них, прибавление которого к раствору возможно в неограниченном количестве без нарушения гомогенности. Растворенным же веществом считается тот компонент, растворимость которого в данном растворе ограничена.
Если компоненты обладают неограниченной взаимной растворимостью, то можно выделить два случая. При значительном различии содержания компонентов в растворе растворителем называется обычно тот из них, который присутствует в относительно большем количестве, а остальные компоненты называются растворенными веществами. Так, при растворении небольшого количества спирта в большом количестве воды можно считать этот раствор раствором спирта в воде и называть воду растворителем, а спирт растворенным веществом. В обратном же случае, т. е. при растворении небольшого количества воды в большом количестве спирта, можно считать растворителем спирт, а воду растворенным веществом. В области промежуточных составов, когда различие в. относительном содержании компонентов невелико, применение этих понятий становится нецелесообразным и может привести к недоразумениям. Количественный состав растворов выражают различными способами. Широко распространено выражение его в массовых % или массовых долях. В физической химии чаще характеризуют его в мольных % или мольных долях, так как зависимость свойств растворов от состава обычно проще при выражении его соотношением мольных количеств компонентов.
Мольная доля Ni компонента iравна отношению числа молей ni этого компонента к сумме чисел молей (ni + n2 + nз+ … +nk)всех K компонентов раствора и определяется по формуле:
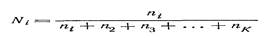
Мольную долю называют также молярной или молекулярной долей или дробью. Мольный процент равен 100 Ni.
Когда компонентами жидкого раствора являются жидкости или когда речь идет о газовых смесях, в некоторых случаях сопоставляют не весовые или мольные, а объемные количества компонентов; при этом выражают состав или в объемных долях, или в объемных процентах, или в объемных отношениях. Например, градусы крепости водно-спиртовых смесей выражают объемный процент спирта в растворе.
Объемная доля φi компонента i определяется по формуле:
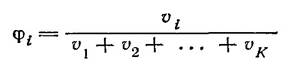

Когда концентрация выражается числом молей растворенного вещества в 1 л раствора, она называется молярностью.В некоторых случаях содержание растворенного вещества относят не к количеству раствора в целом, а к тому или иному количеству растворителя. Так, концентрация, выраженная числом молей растворенного вещества на 1000 г растворителя, называется моляльностью.
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Гипотеза электролитической диссоциации. Вещества, которые в растворе (или расплаве) состоят полностью или частично из ионов, называются электролитами1. В 1805 г. литовский ученый Ф. X. Гроттус, излагая свою теорию электролиза, высказал мнение, что частицы растворенных веществ состоят из положительной и отрицательной частей и под действием электрического поля закономерно ориентируются.
Согласно гипотезе электролитической диссоциации молекулы солей, кислот и оснований при растворении их в воде претерпевают диссоциацию на соответствующие ионы.
. Ионизаия электролитов при растворении. Причины электролитической диссоциации. В молекулах или в кристаллах соединений с ионной связью содержатся не нейтральные атомы элементов, а их ионы, и, например, хлористый натрий состоит из ионов Nа+ и С1- не только в водных растворах, но и в любом его состоянии. Из этих ионов состоят, в частности, и кристалл поваренной соли и молекулы NаС1 в парах. Таким образом, в отношении ионных соединений развитие электронной теории валентности избавило гипотезу электролитической диссоциации от задачи объяснить процесс образования ионов, так как при растворении такого электролита происходит лишь разъединение ионов, а не образование их. Переход ионов в раствор происходит в результате взаимодействия их с молекулами растворителя, в результате образования связей между ионом и молекулами растворителя (сольватация ионов) и, в частном случае, молекулами воды (гидратация ионов).

Под действием электрических полей, создаваемых ионами электролита, полярные молекулы растворителя, например воды, притягиваются ионами, ориентируются около них (рис. 205) и в свою очередь, притягивая ионы к себе, ослабляют этим связь между ними. Подобным же образом они действуют и на ионы, составляющие решетку ионного кристалла, при растворении его в воде (рис. 206).
Однако этим дело не ограничивается. Если диссоциация протекает в растворителях, молекулы которых способны к образованию водородных и донорно-акцепторных связей, то этот вид взаимодействия молекул растворителя с частицами электролита может существенно влиять на ход процесса. Так, в растворителях с высокой диссоциирующей способностью (Н20, НF) именно такое взаимодействие играет часто основную роль в процессе диссоциации.
Как мы видели (см. § 24), связь через водородный атом образуется атомами наиболее электроотрицательных элементов. Молекулы воды обладают способностью к образованию водородной связи не только между собой, но и с другими молекулами, содержащими атомы сильно электроотрицательных элементов. При таком взаимодействии молекулы воды могут через свой водородный атом связываться с наиболее отрицательными атомами других молекул или, наоборот, связываться с водородным атомом другой молекулы, если он несет достаточно высокий положительный заряд, усиливая этим полярность его связи с молекулой. В последнем случае молекула воды может оттянуть к себе этот водород в виде положительного иона, образуя ион гидроксония Н3О+ (см. § 24), Именно благодаря такому взаимодействию вода обладает способностью вызывать сильную диссоциацию некоторых веществ, кристаллизующихся в молекулярных, а не в ионных решетках (например, НС1). Поэтому в этиловом спирте хлористый водород диссоциирует в сильной степени, а в динитробензоле в очень слабой, хотя диэлектрические проницаемости этих растворителей различаются лишь незначительно.
Сильные и слабые электролиты. Свойства растворов слабых электролитов. По способности к диссоциации электролиты разделяются на сильные и слабые.
К сильным принадлежат сильные кислоты, сильные основания и большая часть солей. Сюда относятся не только соли, образованные сильным основанием или сильной кислотой, но большей частью и соли, образованные слабым основанием и слабой кислотой. Большинство сильных электролитов кристаллизуется в кристаллах с ионной решеткой, и сильными электролитами часто называют только такие вещества.
К слабым электролитам принадлежат в первую очередь слабые кислоты и слабые основания, а также некоторые соли. Сюда относятся большинство органических кислот, фенолы, амины, некоторые неорганические основания и кислоты (угольная, синильная), а также такие соли, как хлорная ртуть, цианистая ртуть и др.
По современным представлениям сильные электролиты в растворах различной концентрации (для некоторых электролитов — кроме очень высокой) практически полностью диссоциированы на ионы.
Процесс диссоциации слабых электролитов является обратимым, так как ионы противоположного знака, встречаясь в растворе, могут вновь соединяться в молекулы. Для электролита вида В2А процесс диссоциации представляется уравнением
В2А ==== 2В+ +А2-
Как и во всяком обратимом процессе, здесь устанавливается некоторое равновесие. Количество его можно характеризовать константой равновесия (константой диссоциации Кд), определяемой для разбавленных растворов того же электролита В2А обычным соотношением:
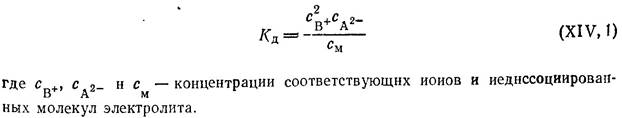
Для характеристики состояния слабого электролита в растворе наряду с константой диссоциации пользуются также и величиной степени диссоциации а, которая определяется отношением:

Константа диссоциации является величиной, свойственной данному электролиту. При постоянной температуре в одном и том же растворителе она должна быть величиной постоянной. Степень же диссоциации характеризует состояние электролита в растворе только данной концентрации и меняется с ее изменением, с уменьшением концентрации она возрастает, приближаясь к единице. Наоборот, с повышением концентрации вероятность взаимной встречи ионов в растворе и их воссоединения в недиссоциированные молекулы возрастает. Поэтому при повышении концентрации степень диссоциации обычно уменьшается.
