Рассмотрим КИЭ в случае бимолекулярной реакции
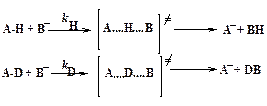
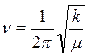 Из теории колебаний известно, что частоты валентных колебаний v связей А—Н и А—D обратно пропорциональны корню квадратному из приведенных масс колеблющихся частиц:
Из теории колебаний известно, что частоты валентных колебаний v связей А—Н и А—D обратно пропорциональны корню квадратному из приведенных масс колеблющихся частиц:
где k - силовая постоянная связи;
μ-приведенная масса осциллятора.
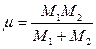
Здесь M1 и M2 — массы колеблющихся атомов, соединенных химической связью.
Из этих выражений можно получить:
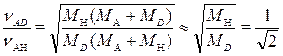
где МH, МD, МA —массы колеблющихся атомов.
Разность нулевых колебательных энергий для связей С-Н, N-H, O-H и, соответственно, С-D, N-Dи О-D составляет примерно (0,13-0,15) hvAH.
В симметричном переходном состоянии связи А...Н и Н...В (или A...D и D...B) равны по силе, и атомы водорода (или дейтерия) не будут колебаться. Таким образом, нулевые колебательные энергии симметричных переходных состояний с участием атомов водорода и дейтерия равны. В таком случае система А-Н+В легче достигает переходного состояния, т.к. ее нулевая колебательная энергия выше.
Соотношение констант скоростей реакций с участием атомов водорода и дейтерия описывается следующим выражением:
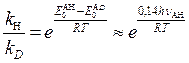
Если переходное состояние в реакции, где разрываются связи С-Н или С-D, несимметрично, нулевые колебательные энергии переходных состояний (А..Н..В)≠ и (А..D..В)≠ не будут равны. Нулевая энергия переходного состояния (А..D..В)≠ несколько ниже, чем переходного состояния (А..Н..В)≠ Тогда кинетический изотопный эффект будет несколько меньше, чем для симметричного переходного состояния. Некоторые значения кинетических изотопных эффектов приведены в табл. 2.1.
Таблица 2.1- Максимальные величины кинетических изотопных эффектов
| Рвущиеся связи | Соотношение констант скорости |
| С-Н, C-D С-Н, С-Т N-H, N-D О-Н, О-D | kCH/ kCD ≈ 8-1 kCH/ kCT ≈ 15-17 kNH/ kND ≈ 9 kOH/ kOD ≈ 10-12 kNHIkW «9 W^OD^10-112 |
Исходя из наличия или отсутствия кинетического изотопного эффекта можно сделать выводы о механизме процесса.
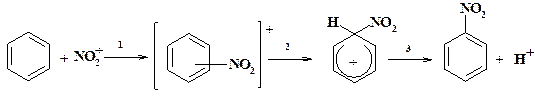 Так, скорость нитрования гексадейтеробензола азотной кислотой не отличается от скорости нитрования обычного бензола С6Н6. Из идентичности скоростей нитрования этих соединений следует вывод, что в стадии, определяющей скорость реакции, не затрагивается связь С—Н. Поэтому наиболее медленной при нитровании является стадия 2 – переход π-комплекса в σ-комплекс, а отщепление протона от последнего протекает быстро:
Так, скорость нитрования гексадейтеробензола азотной кислотой не отличается от скорости нитрования обычного бензола С6Н6. Из идентичности скоростей нитрования этих соединений следует вывод, что в стадии, определяющей скорость реакции, не затрагивается связь С—Н. Поэтому наиболее медленной при нитровании является стадия 2 – переход π-комплекса в σ-комплекс, а отщепление протона от последнего протекает быстро:
В то же время, в реакции нитрования аминов, например, пикрамида:
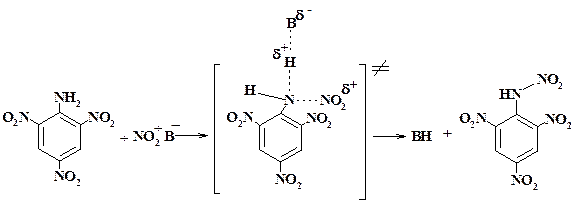
наблюдается кинетический изотопный эффект. В роли основания В могут выступать нитрат-, бисульфат-ионы, молекулы растворителя. Следовательно, разрыв связи N—Н входит в стадию, определяющую скорость реакции.
Вторичный кинетический изотопный эффект имеет место в том случае, когда связь Х-Н или Х-D непосредственно не участвует в реакции. Например,
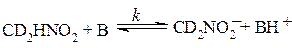
Однако в ходе реакции меняется гибридизация атома углерода, который переходит из состояния sp3в ОН-кислоте в состояние sp2 в анионе. В переходном состоянии атом углерода находится в некотором промежуточном состоянии гибридизации, которое можно обозначить как sp2,5.
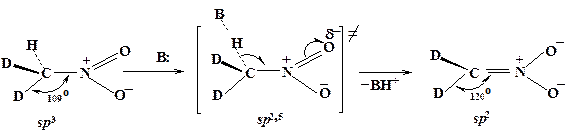
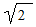 Электроотрицательность атома углерода при увеличении доли s-характера орбитали увеличивается, при этом растет энергия связи С—Н (или С—D), а следовательно, частота и энергия колебаний.
Электроотрицательность атома углерода при увеличении доли s-характера орбитали увеличивается, при этом растет энергия связи С—Н (или С—D), а следовательно, частота и энергия колебаний.
Значения Δν spз  sp2 для связей С—D примерно в раз меньше, чем для связи С-Н:
sp2 для связей С—D примерно в раз меньше, чем для связи С-Н:
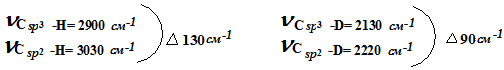
Следовательно, для дейтерированного соединения разница энергий основного и пере-ходного состояния будет меньше, чем для протиевого, и соответствующая реакция пойдет быстрее.
2.6 Изотопный эффект среды и эффекты атомов «тяжелых» элементов
Изотопный эффект среды складывается из первичного и вторичного изотопных эффектов. Механизм его проявления аналогичен рассмотренным выше.
Так, если в реакциях протонизации анионов нитроалканов
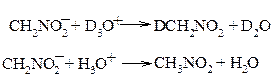
Н3О+ (или D3О+) рассматривать в качестве реагентов, то следует ожидать, что перенос протона от D3О+ будет происходить медленнее, чем от Н3О+, т. к. связь O-D прочнее связи О-Н.
Для реакций протонизации анионов нитроэтана и 1,1-динитроэтана величина кинети-ческого изотопного эффекта среды kH/kD = 3,20, т.е. преобладающее влияние оказывает первичный изотопный эффект.
Изотопные эффекты проявляются и при введении в молекулу изотопов других эле-ментов, а не только атома водорода. Однако в случае «тяжелых» элементов изменение массы атома при переходе от одного изотопа к другому значительно меньше, поэтому изменение энергии колебаний будет меньше и кинетический изотопный эффект будет проявляться значительно слабее.
Тем не менее, кинетические изотопные эффекты «тяжелых» элементов также исполь-зуются для выяснения механизмов реакций. Так, кинетический изотопный эффект при замене изотопа 12С на 14С и 14N на 15N был использован для установления механизма реакции Курциуса. Разложение ацилазидов в реакции Курциуса может в принципе протекать по двум механизмам:
1) в две стадии:
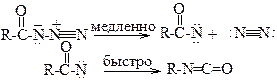
2) по многоцентровому синхронному механизму
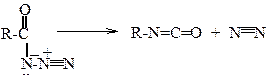
Изотопный эффект максимален для той связи, скорость разрыва которой лимитирует общую скорость реакции.
Измерение кинетического изотопного эффекта проводилось на примере бензоилазида, атомы углерода C1 и C2, a также атомы азота N3 и N4 которого последовательно замещались изотопами 14С и 15N:
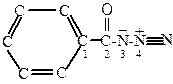
Результаты измерения кинетического изотопного эффекта, представленного в виде (k/k*—1)100 %, где k—константа скорости реакции с легким изотопом, а k*—с тяжелым, приведены в таблице 2.2.
Таблица 2.2- Кинетический изотопный эффект в реакции Курциуса
| Номер атома | Изотопы, на которых велось измерение | КИЭ |
| 12С/14С | 4,2 | |
| 12С/14С | 1.8 | |
| 14N/15N | 3,7 | |
| 14N/15N | 3,7 |
Полученные результаты свидетельствуют в пользу многоцентрового механизма. Если бы реакция протекала по двухстадийному механизму, то кинетический изотопный эффект на атомах азота N3 и N4должен быть максимальным и значительно превышать таковой на атомах углерода C1 и С2.
Таким образом, измерение кинетического изотопного эффекта оказывается полезным инструментом исследования механизмов реакций органических соединений азота.
ЛИТЕРАТУРА
1. А.П.Пурман. А,Б,В…..химической кинетики // Учебник для вузов. ИКЦ «Академкнига», М., 2004, 277с.
2. А.Б.Никольский, А.В.Суворов. Химия // Учебник для вузов. СПб, Химиздат, 2001, 512с.
3. В.Е.Коган, Г.С.Зенин, Н.В.Пенкина // Физическая химия. Часть 2. Химическая кинетика: Учебное пособие. СПб: СзТУ, 2005, 227 с.
4. Н.М.Эммануэль, Д.Г.Кнорре. Курс химической кинетики. М., “Высшая школа”,
1984,463 с.
5. Б.В.Романовский. Основы химической кинетики. Учебник. Изд. “Экзамен”, 2006, 416 с.
6. Е.Г.Денисов. Кинетика гомогенных химических реакций. М., “Высшая школа”, 1978, 345 с.
7. Л.Гаммет. Основы физической органической химии. Изд. “Мир”, М., 1972,534 с.
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ…………………………………………………………………………… 3
1. ОСНОВЫ ФОРМАЛЬНОЙ КИНЕТИКИ ………………………………………… 5
1.1. Скорость химической реакции …………………………………………….. 5
1.2. Закон действия масс …………………………………………………………. 6
1.3. Реакции простых типов ………………………………………………………… 8
1.4. Константа скорости реакции ………………………………………………….. 9
1.5. Уравнение Аррениуса …………………………………………………………. .9
1.6. Нулевой порядок реакции ……………………………………………………. 11
1.7. Понятие псевдопорядка реакции……………………………………………….11
1.8. Кинетика гетерофазных реакций в системе жидкость-жидкость…………….12
1.9. Методы определения констант скоростейи порядковхимических
реакций……………………………………………… ………………………….14
1.10.Обратимые реакции ……………………………………………………….… 18
1.11.Параллельные реакции …………………………………………………….… 19
1.12.Последовательные реакции…………………… .…………………………. 22
1.13. Последовательные реакции с обратимыми стадиями.
Принцип стационарного состояния…………………..…………………… 24
2. ОСНОВЫ ТЕОРИИ АБСОЛЮТНЫХ СКОРОСТЕЙ РЕАКЦИЙ…………… .29
2.1. Поверхность потенциальной энергии ………………………………………. ..29
2.2. Теория абсолютных скоростей реакций ……………………………………….35
2.3. Термодинамическая формулировка скоростей реакций……………………....40
2.4. Истинная энергия активации ………………………………………………… ..42
2.5. Кинетический изотопный эффект ……………………………………………. .43
2.6. Изотопный эффект среды и эффекты атомов «тяжелых» элементов …. .... .. 47
ЛИТЕРАТУРА…………………………………………………………………………50
Кафедра химии и технологии органических соединений азота
Текст лекций
