Химико-термодинамичские расчеты
Термодинамика изучает закономерности теплового движения. Для количественного их описания используются функции состояния, в частности внутренняя энергия U, энтальпия Н, энтропия S и изобарно-изотермический потенциал G, который также называется энергией Гиббса. В ходе химических реакций эти функции изменяются, что позволяет охарактеризовать энергетические эффекты, сопровождающие химические процессы, а также направление и пределы их протекания.
Внутренняя энергия системы U равна сумме энергий поступательного и вращательного движения молекул, внутримолекулярных колебаний атомов и атомных групп, кинетической и потенциальной энергий электронов и т. д. В эту сумму не входят потенциальная энергия, обусловленная положением системы в пространстве, и кинетическая энергия системы как целого. Изменение DU внутренней энергии равно тепловому эффекту Qр реакции, протекающей при постоянном объеме (изохорный процесс). Если DU < 0, то тепло выделяется в количестве, равном ½DU½(экзотермическая реакция, Qр < 0). Если DU > 0, то тепло поглощается в количестве, равном DU (эндотермическая реакция, Qр > 0).
Часто химические реакции идут не при постоянном объеме, а при постоянном давлении (изобарный процесс). Тогда система совершает работу. В этом случае, как следует из закона сохранения энергии, тепловой эффект Qр реакции равен изменению DH энтальпии H, которая определяется соотношением
H = U + PV, (3.1)
где P – давление; V – объем системы.
Внутренняя энергия U, энтальпия Н и энергия Гиббса G имеют одну и ту же размерность: обычно это джоули или килоджоули. Их численные значения так же, как и энтропии S, зависят от многих термодинамических параметров, таких, как температура T, давление P, химический состав и т. д. В справочниках обычно приводятся величины, соответствующие стандартному состоянию вещества.
Стандартным состоянием вещества при данной температуре называется его состояние в виде чистого вещества при давлении (в случае газов – при парциальном давлении данного газа), равном нормальному атмосферному давлению (101,325 кПа, или 760 мм рт. ст.). Условия, при которых все участвующие в реакции вещества находятся в стандартных состояниях, называются стандартными условиями протекания реакции.
Стандартные величины и их изменения принято обозначать индексом °, например H°, DH°, DS°, G°. Часто указывается также и температура в градусах Кельвина: H°298, DH°298, S°298. Изменения вышеперечисленных величин обычно относят к тому случаю, когда все исходные вещества и все продукты реакции находятся в стандартных состояниях.
Стандартная энтальпия реакции образования 1 моля вещества из простых веществ называется стандартной энтальпией образования этого вещества. Эту величину обычно выражают в килоджоулях на моль. Она равна нулю для простых веществ, поскольку для их образования из тех же самых простых веществ не требуется никакой химической реакции: DH°298 = 0. Если элемент образует несколько простых веществ (графит и алмаз, белый и красный фосфор и т. п.), то стандартным считается состояние элемента в виде наиболее устойчивой модификации (например, графит в случае углерода). Энтальпия, внутренняя энергия и энергия Гиббса образования наиболее устойчивой модификации простых веществ принимаются равными нулю.
Химические уравнения, в которых указаны изменения энтальпии (тепловые эффекты реакций), называются термохимическими уравнениями, например, уравнение
РbО(к) + СО(г) = Рb(к) + СО2(г); DH°х.р = - 64 кДж.
Поскольку энтальпия химической реакции DH°х.р < 0, то данная реакция является экзотермической. Иначе говоря, при восстановлении 1 моля РbО оксидом углерода (II) выделяется количество теплоты, равное 64 кДж. Индексы к, ж и г указывают соответственно на кристаллическое, жидкое и газообразное состояния вещества.
Химико-термодинамичские расчеты основаны на законе Гесса (1840 г), который непосредственно следует из закона сохранения энергии. Закон Гесса: тепловой эффект химической реакции (т. е. изменение энтальпии или внутренней энергии системы в результате реакции) зависит только от начального и конечного состояний участвующих в реакции веществ и не зависит от промежуточных стадий процесса. Легко показать, что термохимические уравнения можно складывать, вычитать и умножать на численные множители.
Пример 1. Исходя из теплоты образования газообразного диоксида углерода (DH° = -393,5 кДж/моль) и термохимического уравнения
С(графит) + 2N2O(г) = СО2(г) + 2N2(г), DH°х.р = -557,5 кДж (3.2)
вычислить теплоту образования N2O(г).
Решение. Обозначим искомую величину через x. Запишем термохимическое уравнение образования N2O из простых веществ:
N2(г) + 1/2 О2(г) = N2O(г), DH°х.р = x кДж. (3.3)
Термохимическое уравнение реакции образования СО2(г.) из простых веществ таково:
С(графит) + О2(г) = СО2 (г), DH°х.р = -393,5 кДж. (3.4)
Из уравнений (3.3) и (3.4) можно получить уравнение (3.2). Для этого умножим уравнение (3.3) на два и вычтем найденное уравнение из (3.4):
С(графит) + 2N2O(г) = СО2(г) + 2N2(г), DH°х.р. = (-393,5 - 2x) кДж. (3.5)
Сравнивая уравнения (3.2) и (3.5), находим: -393,5 - 2x = -557,5, откуда x = 82,0 кДж/моль.
Химико-термодинамичские расчеты удается часто значительно упростить, используя следующее следствие из закона Гесса: изменение энтальпии DH°х.р химической реакции равно сумме энтальпий образования DHiпрод продуктов реакции за вычетом суммы энтальпий образования DHjисх исходных веществ:
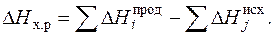 (3.6)
(3.6)
При каждом суммировании в (3.6) следует учитывать в соответствии с уравнением реакции число молей участвующих в реакции веществ. Приведем пример, иллюстрирующий это следствие.
Пример 2. Определить стандартное изменение энтальпии DH°х.р реакции горения метана
СН4(г) + 2О2(г) = СО2(г) + 2Н2О(г)
зная, что стандартные энтальпии образования СО2(г), Н2О(г) и СН4(г) равны соответственно -393,5, -241,8 и -74,9 кДж/моль.
Решение. Искомая величина согласно (3.6) такова:
DH°х.р. = (DH°СО2+ 2 DH°Н2О) – (DH°СН4+ 2 DH°О2).
Используя исходные данные и учитывая, что DH°О2= 0, имеем
DH°х.р = -393,5 - 241,8 × 2 + 74,9 = -802,2 кДж.
Химико-термодинамичские расчеты позволяют не только предсказать тепловой эффект реакции. Не менее важно заранее знать, может ли вообще протекать интересующая нас реакция. Направление, в котором самопроизвольно протекает химическая реакция, определяется действием двух факторов: 1) тенденцией к переходу системы в состояние с наименьшей внутренней энергией (в случае изобарных процессов – с наименьшей энтальпией) и 2) тенденцией к достижению наиболее вероятного состояния, т. е. состояния, которое может быть реализовано наибольшим числом микросостояний.
Мерой первой из этих тенденций для изобарных процессов служит изменение DHх.р энтальпии химической реакции. Мерой второй – изменение DSх.р энтропии S, которая пропорциональна логарифму числа равновероятных микросостояний, которыми может быть реализовано данное макросостояние.
Макросостояние задается определенными значениями таких макроскопических характеристик системы, как температура, давление, объем и т. п. Микросостояние задается путем детализации взаимного расположения атомов, молекул, их скоростей и т. п. Одному и тому же макросостоянию обычно соответствует очень большое число различных микросостояний.
Если газ первоначально занимал половину предоставленного ему объема, то затем он самопроизвольно займет весь объем. Дело в том, что число равновероятных микросостояний в половине объема значительно меньше аналогичной величины для целого объема. В результате возрастет энтропия S, которая пропорциональна логарифму числа равновероятных микросостояний.
Энтропия возрастает при переходе вещества из кристаллического состояния в жидкое и из жидкого в газообразное, при растворении кристаллов, при химических взаимодействиях, приводящих к увеличению числа частиц, и прежде всего частиц в газообразном состоянии. Напротив, все процессы, в результате которых упорядоченность системы возрастает (конденсация, полимеризация, сжатие, уменьшение числа частиц), сопровождаются уменьшением энтропии.
Энтропия имеет размерность энергии, деленной на температуру. В справочниках численные значения энтропии приведены для одного моля вещества и выражаются в Дж/(моль×К). В отличие от энтальпии образования, энтропия простого вещества не равна нулю, так как при температуре, отличной от абсолютного нуля, макросостояние может быть реализовано не единственным микросостоянием, а большим числом равновероятных микросостояний.
Функцией состояния, одновременно учитывающей влияние обеих упомянутых выше тенденций на направление протекания химических процессов, является энергия Гиббса G:
G = H - T× S, (3.7)
где Т – абсолютная температура. Энергия Гиббса имеет ту же размерность, что и энтальпия, поэтому обычно выражается в джоулях или килоджоулях. Численные значения энергии образования Гиббса, приведенные в справочниках, обычно отнесены к 1 молю вещества и выражены в кДж/моль.
При постоянстве температуры и давления химические реакции могут самопроизвольно протекать только в таком направлении, при котором энергия Гиббса системы уменьшается (DGх.р < 0).
Для энтропии S и энергии Гиббса G справедливо утверждение, аналогичное приведенному выше для DHх.р (3.6): изменение энтропии (или энергии Гиббса) в результате химической реакции равно сумме энтропий (или энергий Гиббса) продуктов реакции за вычетом суммы энтропий (или энергий Гиббса) исходных веществ. Суммирование производят с учетом числа молей участвующих в реакции веществ. Изменение энтропии S (или энергии Гиббса G) определяется формулой .(3.6), если в последней заменить H соответственно на S (или G).
Приведем пример, иллюстрирующий, как с помощью энергии Гиббса определить направление протекания химической реакции.
Пример 3. Может ли в стандартных условиях при температуре 298 K в прямом направлении самопроизвольно протекать реакция
Cl2(г) + 2НI(г) = I2(к) + 2НCl(г)?
Можно ли изменить направление протекания этой реакции за счет повышения температуры?
Решение. Заменив в .(3.6) H на G и используя справочные данные (табл. 4 прил.) для температуры 298 K, находим:
DGх.р = (-95,2) 2 - (1,8) 2 = -194 кДж.
Поскольку DGх.р < 0, то рассматриваемая реакция при температуре 298 K самопроизвольно протекает в прямом направлении.
Положительный ответ на второй вопрос определяется тем обстоятельством, что в ходе реакции число молей веществ в газообразном состоянии уменьшается, поэтому DSх.р < 0. Тогда при достаточно высоких температурах, удовлетворяющих неравенству T > DHх.р /DSх.р, знак DGх.р = DHх.р - T × DSх.р изменится, станет положительным, реакция будет протекать в обратном направлении.
ЗАДАЧИ *
3.1. При соединении 2,1 г железа с серой выделилось 3,77 кДж. Составить термохимическое уравнение реакции. Рассчитать энтальпию образования сульфида железа.
Ответ: -100,3 кДж/моль.
3.2. Гремучий газ представляет собой смесь двух объемов водорода и одного объема кислорода. Найти количество теплоты, выделяющейся при взрыве 8,4 л гремучего газа, взятого при нормальных условиях. Составить термохимическое уравнение реакции.
Ответ: 60,5 кДж.
3.3. Определить стандартную энтальпию образования РН3 исходя из уравнения
2РН3(г) + 4O2(г) = Р2O5(к) + 3Н2O(ж); DH°х.р = -2360 кДж.
Ответ: 5,3 кДж/моль.
3.4. Исходя из теплового эффекта реакции
3СаО(к) + Р2О5(к) = Са3(РО4)2(к); DH°х.р = -739 кДж
определить DH°298 образования ортофосфата кальция.
Ответ: -4137,5 кДж/моль.
3.5. Исходя из уравнения реакции
СН3ОН(ж) + 3/2 О2(г) = СО2(г) + 2Н2О(ж); DH°х.р = -726,5 кДж
вычислить DH°298 образования метилового спирта.
Ответ: -238,6 кДж/моль.
3.6. При восстановлении 12,7 г оксида меди (II) углем (с образованием CO) поглощается 8,24 кДж. Определить DH°298 образования СuО.
Ответ: -162,1 кДж/моль.
3.7. При полном сгорании этилена (с образованием жидкой воды) выделилось 6226 кДж. Составить термохимическое уравнение реакции. Найти объем вступившего в реакцию кислорода (условия нормальные).
Ответ: 296,5 л.
3.8. Водяной газ представляет собой смесь равных объемов водорода и оксида углерода (II). Найти количество теплоты, выделяющейся при сжигании 112 л водяного газа, взятого при нормальных условиях.
Ответ: 1312 кДж.
3.9. Сожжены с образованием Н2О(г) равные объемы водорода и ацетилена, взятых при одинаковых условиях. Составить термохимические уравнения реакций. В каком случае выделится больше теплоты? Во сколько раз?
Ответ: При сжигании С2Н2 в 5,2 раза больше.
3.10. Определить DH°298 реакции 3С2Н2(г) = С6Н6(ж) и тепловой эффект реакции сгорания ацетилена с образованием СО2(г) и Н2О(ж).
Ответ: -597,5 кДж; -2599,2 кДж.
3.11. Определить DH°298 образования этилена, используя следующие данные:
С2Н4(г) + 3О2(г) = 2СО2(г) + 2Н2О(г); DH°х.р = -1323 кДж
С(графит) + О2(г) = СО2(г); DH°х.р = -393,5 кДж
Н2(г) + 1/2 O2(г) = Н2О(г); DH°х.р = -241,8 кДж
Ответ: 52,4 кДж/моль.
3.12. Сравнить DH°х.р реакций восстановления оксида железа (III) различными восстановителями при 298 К:
а) Fe2O3(к) + 3Н2(г) = 2Fe(к) + 3Н2О(г)
б) Fe2O3(к) + 3С(графит) = 2Fe(к) + 3СО(г)
в) Fe2О3(к) + 3СО(г) = 2Fe(к) + 3СО2(г)
Ответ: а) 96,8 кДж; б) 490,7 кДж; в) -26,8 кДж.
3.13. Найти массу метана, при полном сгорании которого (с образованием жидкой воды) выделяется теплота, достаточная для нагревания 100 г воды от 20 до 30°С. Мольную теплоемкость воды принять равной 75,3 Дж/(моль×К).
Ответ: 0,086 г.
3.14. Вычислить DH°298 образования MgCO3(к) при 298 К, используя следующие данные:
С(графит) + О2(г) = СО2(г); DH°х.р = -393,5 кДж
2Mg(к) + О2 = 2MgO(к); DH°х.р = -1203,6 кДж
MgO(к) + СО2(г) = MgCO3(к.); DH°х.р = -117,7 кДж
Ответ: -1113 кДж/моль.
3.15. Исходя из DH°298 образования Н2О(г) и следующих данных:
FeО(к) + СО(г) = Fe(к) + СО2(г); DH°х.р = -18,2 кДж
2СО(г) + О2(г) = 2СО2(г); DH°х.р = -566,0 кДж
вычислить DH°х.р реакции:
FeO(к) + Н2(г) = Fe(к) + Н2О(г).
Ответ: 23,0 кДж.
3.16. Вычислить DH°х.р реакций:
а) С2Н6(г) + 7/2 О2(г) = 2СО2(г) + 3Н2О(г)
б) С6Н6(ж) + 15/2 О2(г) = 6СО2(г) + 3Н2О(ж)
Ответ: а) -1423 кДж; б) -3301 кДж.
3.17. Вычислить DH°х.р реакций:
а) 2Li(к) + 2 Н2О(ж) = 2Li+(водн) + 2ОН-(водн) + Н2(г)
б) 2Na(к) + 2Н2О(ж) = 2Na+(водн) + 2ОН- (водн) + Н2(г)
Стандартные энтальпии образования Li+(водн), Na+(водн) и ОН-(водн) принять соответственно равными -278,5, -239,7 и -228,9 кДж/моль.
Ответ: а) -443,2 кДж; б) -365,6 кДж.
3.18. Вычислить значение DH°х.р для следующих реакций превращения глюкозы:
а) С6Н12О6(к) = 2С2Н5ОН(ж) + 2СО2(г)
б) С6Н12О6(к) + 6О2(г) = 6СО2(г) + 6Н2О(ж)
Какая из этих реакций поставляет больше энергии?
Ответ: а) -69,2 кДж; б) -2803 кДж.
3.19. Рассчитать значения DG°х.р следующих реакций и установить, в каком направлении они могут протекать самопроизвольно в стандартных условиях при 25°С:
а) NiО(к) + Рb(к) = Ni(к) + РbО(к)
б) Рb(к) + СuО(к) = РbО(к) + Сu(к)
в) 8 А1(к) + 3 Fe3О4(к) = 9Fe(к) + 4А12О3(к)
Ответ: а) 22,5 кДж; 6) -59,2 кДж, в) -3285 кДж.
3.20. Вычислить DG°х.р для реакции
СаСО3(к) = СаО(к) + СО2(г)
при 25, 500 и 1500°С. Зависимостью DH°х.р DS°х.р от температуры пренебречь. Построить график зависимости DG°х.р от температуры и найти по графику температуру, выше которой указанная реакция будет протекать самопроизвольно.
Ответ: 129,1 кДж; 50,7 кДж; -114,0 кДж; около 1080 К.
3.21. Вычислить значения DG°х.р следующих реакций восстановления оксида железа (II):
а) FeО(к) + 1/2 С(графит) = Fe(к) + 1/2 СО2(г)
б) FeO(к) + С(графит) = Fе(к) + СО(г)
в) FеО(к) + СО(г) = Fе(к) + СО2(г)
Протекание какой из этих реакций наиболее вероятно?
Ответ: а) 47,1 кДж; б) 107,2 кДж; в) -13,0 кДж.
3.22. Вычислить, какое количество теплоты выделится при восстановлении Fе2О3 металлическим алюминием, если было получено 335,1 г железа.
Ответ: 2561,6 кДж.
3.23. Газообразный этиловый спирт С2Н5ОН можно получить при взаимодействии этилена С2Н4(г) и водяных паров. Написать термохимическое уравнение этой реакции, вычислив ее тепловой эффект.
Ответ: -45,8 кДж.
3.24. Вычислить тепловой эффект реакции восстановления оксида железа (II) водородом исходя из следующих термохимических уравнений:
FeO(к) + СО(г) = Fe(к) + СО2(г); DH°х.р = -13,18 кДж
СО(г) + 1/2 О2(г) = СО2(г); DH°х.р = -283,0 кДж
Н2(г) + 1/2 О2(г) = Н2О(г); DH°х.р = -241,83 кДж
Ответ: +27,99 кДж.
3.25. При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерод CS2(г). Написать термохимическое уравнение этой реакции и вычислить ее тепловой эффект.
Ответ: 67,18 кДж.
3.26. Написать термохимическое уравнение реакции между СО(г) и водородом, в результате которой образуются СН4(г) и Н2О(г). Сколько теплоты выделится в результате этой реакции, если было получено 67,2 л метана в пересчете на нормальные условия?
Ответ: 618,6 кДж.
3.27. Тепловой эффект какой реакции равен теплоте образования NO? Вычислить теплоту образования NO исходя из следующих термохимических уравнений:
4NH3(г) + 5О2(г) = 4 NO(г) + 6Н2О(ж); DH°х.р = -1168,80 кДж
4NH3(г) + 3О2(г) = 2N2(г) + 6Н2О(ж); DH°х.р = -1530,28 кДж
Ответ: 90,37 кДж.
3.28. Тепловой эффект какой реакции равен теплоте образования метана? Вычислить теплоту образования метана исходя из следующих термохимических уравнений:
Н2(г) + 1/2 O2(г) = Н2О(ж); DH°х.р = -285,84 кДж
С(к) + О2(г) = СО2(г); DH°х.р = -393,51 кДж
СН4(г) + 2 О2(г) = 2Н2О(ж) + СО2(г); DH°х.р = -890,31 кДж
Ответ: -74,88 кДж.
3.29. Тепловой эффект какой реакции равен теплоте образования гидроксида кальция? Вычислить теплоту образования гидроксида кальция, исходя из следующих термохимических уравнений:
Са(к) + 1/2 О2 (г) = СаО(к); DH°х.р = -635,60 кДж
Н2(г) + 1/2 О2(г) = Н2О(ж); DH°х.р = -285,84 кДж
СаО(к) + Н2О(ж) = Са(ОН)2(к); DH°х.р = -65,06 кДж
Ответ: -986,50 кДж.
3.30. При получении эквивалентной массы гидроксида кальция из СаО(к) и Н2О(ж) выделяется 32,53 кДж теплоты. Написать термохимическое уравнение этой реакции и вычислить теплоту образования оксида кальция.
Ответ: -635,5 кДж.
