Электрохимические процессы
Химические процессы, сопровождающиеся возникновением электрического тока или вызываемые им, называются электрохимическими.
Рассмотрим такой опыт (рис 7.1). В стаканы, один из которых содержит раствор сульфата цинка (II), а другой - раствор сульфата меди (II), погружены соответственно цинковая и медная пластинки, соединенные друг с другом металлическим проводником. Если растворы в свою очередь соединить друг с другом соляным мостиком (U-образная трубка с насыщенным раствором КС1), то через некоторое время в обоих стаканах можно наблюдать химические превращения: в первом стакане происходит растворение цинковой пластинки, а во втором — осаждение меди из раствора на медной пластинке. Превращения легко подтвердить взвешиванием высушенных металлических пластинок. Указанные химические изменения являются результатом переноса электронов от одной части системы к другой. Это типичный электрохимический процесс.
поток электронов
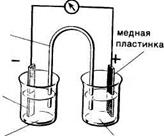
раствор КС1
цинковая пластинка
ZnSO4 CuSO4
([Zn2+ ] = 1 моль/л) ([Cu2+ ] = 1 моль/л)|
Zn→-Zn2++2e Cu2++2e→Cu
Рис. 7.1. Электрохимический процесс
Чтобы понять природу электрохимических процессов, обратимся к более простому случаю. Представим себе металлическую пластинку, погруженную в воду. Под действием полярных молекул воды ионы металла отрываются от поверхности пластинки и гидратированными переходят в жидкую фазу. Последняя при этом заряжается положительно, а на металлической пластинке появляется избыток электронов. Чем дальше протекает процесс, тем больше становится заряд, как пластинки, так и жидкой фазы.
Благодаря электростатическому притяжению катионов раствора и избыточных электронов металла на границе раздела фаз возникает двойной электрический слой. Естественно, что он тормозит дальнейший переход ионов металла в жидкую фазу. Наконец наступает момент, когда между раствором и металлической пластинкой устанавливается равновесие, которое можно выразить уравнением:
Me(тв)↔Men+(p - p) + ne
или с учетом гидратации ионов в растворе:
Me + mН2О↔Ме(Н2О)n+m + ne
Состояние этого равновесия зависит от природы металла, концентрации его ионов в растворе, от температуры и давления.
При погружении металла не в воду, а в раствор соли этого металла равновесие в соответствии с принципом Ле Шателье смещается влево, и тем больше, чем выше концентрация ионов металла в растворе. Активные металлы, ионы которых обладают хорошей способностью переходить в раствор, будут и в этом случае заряжаться отрицательно, хотя в меньшей степени, чем в чистой воде.
Равновесие можно сместить вправо, если тем или иным способом удалять электроны из металла. Это приведет к растворению металлической пластинки. Наоборот, если к металлической пластинке подводить электроны извне, то на ней будет происходить осаждение ионов из раствора.
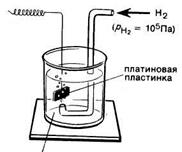
раствор, содержащий ионы водорода ([Н + ]= 1 моль/л)
Рис. 7.2 Стандартный водородный электрод
Как уже отмечалось, при погружении металла в раствор на границе раздела фаз образуется двойной электрический слой. Разность потенциалов, возникающую между металлом и окружающей его жидкой средой, называют электродным потенциалом. Этот потенциал является характеристикой окислительно-восстановительной способности металла в виде твердой фазы. Заметим, что у изолированного металлического атома (состояние одноатомного пара, возникающее при высоких температурах и высоких степенях разрежения) окислительно-восстановительные свойства характеризуются другой величиной, называемой ионизационным потенциалом. Ионизационный потенциал - это энергия, необходимая для отрыва электрона от изолированного атома.
Абсолютное значение электродного потенциала нельзя измерить непосредственно. Вместе с тем не представляет труда измерение разности электродных потенциалов, которая возникает в системе, состоящей из двух пар металл - раствор. Такие пары называют полуэлементами. Условились определять электродные потенциалы металлов по отношению к так называемому стандартному водородному электроду, потенциал которого произвольно принят за нуль. Стандартный водородный электрод состоит из специально приготовленной платиновой пластинки, погруженной в раствор серной кислоты с концентрацией ионов водорода, равной 1 моль/л, и омываемой струей .газообразного водорода под давлением 105 Па, при температуре 25°С (рис. 7.2).
Возникновение потенциала на стандартном водородном электроде можно представить следующим образом. Газообразный водород, адсорбируясь платиной, переходит в атомарное состояние: Н2↔2Н
Между атомарным водородом, образующимся на поверхности платины, ионами водорода в растворе и платиной (электроны!) реализуется состояние динамического равновесия: H ↔H + е
Суммарный процесс выражается уравнением: Н2↔2Н+ +2е
Платина не принимает участия в окислительно-восстановительном процессе, а является лишь носителем атомарного водорода.
Если пластинку металла, погруженную в раствор его соли с концентрацией ионов металла, равной 1 моль/л, соединить со стандартным водородным электродом, то получится гальванический элемент. Электродвижущая сила этого элемента (ЭДС), измеренная при 25° С, и характеризует стандартный электродный потенциал металла.
В таблице 7.1 представлены значения стандартных электродных потенциалов некоторых металлов. Символом Ме+/Ме обозначен металл Me, погруженный в раствор его соли. Стандартные потенциалы электродов, выступающих как восстановители по отношению к водороду, имеют знак « — », а знаком « + » отмечены стандартные потенциалы электродов, являющихся окислителями.
Таблица 7.1. Стандартные электродные потенциалы
Металлов
| Электрод | E°, В | Электрод | E°, В |
| Li+/Li | -3,02 | Co2+/Co | - 0,28 |
| Rb+/Rb | -2,99 | Ni2 + /Ni | -0,25 |
| К + /К | -2,92 | Sn2+/Sn | -0,14 |
| Ва2+/Ва | -2,90 | Pb2+/Pb | -0,13 |
| Sr2+/Sr | -2,89 | Н+/1/2Н2 | 0,00 |
| Са2+/Са | -2,87 | Sb3+/Sb | + 0,20 |
| Na+/Na | -2,71 | Bi3+/Bi | + 0,23 |
| La3+/La | -2,37 | Cu2+/Cu | + 0,34 |
| Mg2+/Mg | -2,34 | Cu + /Cu | + 0,52 |
| А13+/А1 | - 1,67 | Hg2+/2Hg | + 0,79 |
| Mn2+/Mn | - 1,05 | Ag+/Ag | + 0,80 |
| Zn2+/Zn | -0,76 | Pd2+/Pd | + 0,83 |
| Cr3 + /Cr | - 0,71 | Hg2+/Hg | + 0.86 |
| Fe2+/Fe | -0,44 | Pt2+/Pt | + 1,20 |
| Cd2+/Cd | -0,40 | Au3+/Au | + 1,42 |
Металлы, расположенные в порядке возрастания их стандартных электродных потенциалов, образуют так называемый электрохимический ряд напряжений металлов:
