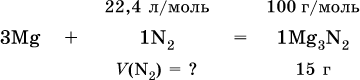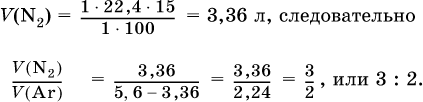Задания для самостоятельного решения части В
1. Установите массовую долю (в %) хлорида калия в растворе, приготовленным из 0,65 моль соли и 300 мл воды.
2. Приготовлено 300 г 5%‑ного раствора иода в этаноле. Рассчитайте массу (в граммах) использованного спирта.
3. Какой объем (в литрах, н. у.) метаналя необходимо растворить в 500 мл воды, чтобы приготовить 30 %‑ный формалин.
4. Рассчитайте массовую долю (в %) сульфата цинка (II), если раствор приготовлен из 0,75 моль кристаллогидрата ZnSO4 7Н2Oи 600 г воды.
5. Найдите массу (в граммах) кристаллогидрата CuSO4 5Н2O, которую необходимо взять для приготовления 160 г 10 %‑ного раствора безводной соли.
6. Бромоводород объемом 5,4 л (н. у.) затрачен на приготовление 8 %‑ного раствора (плотность равна 1056,8 г/л). Вычислите объем (в литрах) этого раствора.
7. Определите массу (в граммах) добавленной воды, необходимой для приготовления 10 %‑ного раствора из 1 моль дигидрата гидроксида калия.
8. Установите массу (в граммах) 4 % – ного раствора нитрата калия, приготовленного путем разбавления водой из 20 г 15 %‑ного раствора.
9. Рассчитайте, до какого объема (в литрах) надо разбавить водой 700 г 50,5 %‑ного раствора ацетата калия, чтобы приготовить 7,7 %‑ный раствор с плотностью 1038 г/л.
10. Какой объем (в литрах) воды необходим для разбавления 200 мл 96 %‑ного этанола (плотность 0,8 г/мл) до 10 %‑ного спирта?
11. К 100 г 35 %‑ного водного раствора метанола добавили 50 г того же вещества. Найдите массовую долю (в %) спирта в конечном растворе.
12. К 250 мл 8% – ного раствора нитрата серебра (I) добавили еще соли и приготовили 16 %‑ный раствор. Установите добавленное количество соли (моль).
13. Какой объем (в литрах, н. у.) аммиака надо растворить в 1 л 10 %‑ного раствора (плотность 0,96 г/мл) того же вещества для приготовления 15 %‑ного раствора?
14. Определите массовую долю (в %) нитрата натрия в конечном растворе, приготовленным смешиванием 90 г 5%‑ного и 120 г 40 %‑ного растворов.
15. Какую массу в граммах 96 %‑ный серной кислоты надо смешать с 200 г 5%‑ный кислоты, чтобы приготовить 20 %‑ный раствор?
16. Смешали 250 мл 30 %‑ного водного раствора метанола (плотность раствора 0,954 г/мл) и 300 г 40 %‑ного раствора того же спирта. Какой станет массовая доля (в %) вещества в конечном растворе?
17. Заполнили колбу вначале хлороводородом (н. у.), затем водой. Какова массовая доля (в %) вещества в приготовленном растворе?
18. Гидроортофосфат кальция образует 0,02 %‑ный насыщенный раствор в комнатных условиях. Найдите минимальный объем (в литрах) воды, требующийся для растворения 100 г соли.
19. Приготовлен раствор из 219 г кристаллогидрата СаCl2 6Н2O и 1 л воды. Рассчитайте массовую долю (в %) безводной соли в этом растворе.
20. Определите количество гидроксида калия (моль), содержащееся в 3 л 25 %‑ного раствора (плотность 1,24 г/мл).
21. Найдите объем (мл) воды, в котором надо растворить 70 г Fe(NO3)3 9Н2O для приготовления 12 %‑ного раствора.
22. Каким количеством воды (моль) надо разбавить 500 мл 20 %‑ный азотной кислоты (плотность 1,12 г/мл), чтобы приготовить 8 %‑ный раствор?
23. Разбавлением водой приготовлен 1 кг 3,5 %‑ный уксусной кислоты из 70 %‑ной (плотность 1,069 г/мл). Найдите объем (мл) исходного раствора кислоты.
24. Приготовили раствор 10 г сахарозы в 200 г воды. Затем раствор упарили вдвое (по объему). Определите массовую долю (в %) углевода в конечном растворе.
25. К 1 л 25 %‑ного раствора едкого натра (плотность раствора 1,28 г/мл) добавляют порцию той же щелочи и готовят 35 %‑ный раствор. Рассчитайте массу (в граммах) этой порции.
26. Смешали 300 мл 10 %‑ный хлороводородной кислоты (плотность 1,05 г/мл) и 100 г 5%‑ной кислоты. Определите массовую долю (в %) растворенного вещества в конечном растворе.
27. Водный 5 %‑ный раствор нитрата стронция массой 320 г смешали с 45 г 38 %‑ного раствора того же вещества. Рассчитайте конечную массовую долю (в %) растворенного вещества.
Объемное отношение газов
Для химической реакции aA + bB = cC + dDвыполняется соотношение
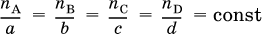
где nА и nВ – количества вступивших в реакцию исходных веществ, пС и nD – количества образовавшихся продуктов, а, b, с и d – стехиометрические коэффициенты.
От количеств веществ легко перейти к их массам:
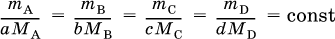
Для газообразных веществ чаще задают или определяют их объемы. Если реагент В и продукт D – газы, то проводят переход от количеств этих веществ к их объемам:
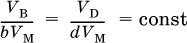
При известных (по условию) количестве, массе или объеме (для газа) одного из веществ, участвующих в реакции, можно рассчитать значения всех величин для остальных веществ.
В случае смеси газов А и В, один из которых участвует в реакции, можно найти взятое соотношение их объемов VA : VB, а при заданном соотношении – объем их смеси (или наоборот).
Пример решения задачи
При высокой температуре магний реагирует с азотом, взятым в виде смеси с аргоном, общим объемом 5,6 л (н.у.), и образует 15 г нитрида. Рассчитайте объемное отношение газов V(N2): V(Ar) в исходной смеси.