Параметры для характеристики атомов
Массовое число А – сумма чисел протонов и нейтронов атома.
Заряд ядра Z – число протонов, определяется по порядковому номеру элемента в таблице Д.И.Менделеева.
В 1913 г. английским физиком Г.Мозли было установлено, что положительный заряд ядра атома (в условных единицах) равен порядковому номеру элемента в периодической системе Д.И.Менделеева.
Число нейтронов N определяется как разность между массовым числом и зарядом ядра (учитывая, что массой электрона можно пренебречь).
Изотопы – атомы одного элемента, имеющие одинаковый заряд ядра (следовательно, и количество электронов), но различное число нейтронов (следовательно, различные массовые числа). Например, элемент водород имеет три изотопа: протий, дейтерий и тритий. Первые два существуют в природе, тритий получен искусственным путем. Подавляющее большинство химических элементов имеет разное число природных изотопов с разным процентным содержанием каждого из них. Относительная атомная масса элемента, которая приводится в периодической системе, – это средняя величина массовых чисел природных изотопов данного элемента с учетом процентного содержания каждого из этих изотопов. Химические свойства всех изотопов одного химического элемента одинаковы. Следовательно, химические свойства элемента зависят не от атомной массы, а от заряда ядра.
Помимо изотопов существуют изобары – атомы разных химических элементов, которые имеют одинаковые массовые числа, и изотоны – атомы разных химических элементов, которые имеют одинаковое число нейтронов.
Радиоактивность. Ядерные реакции
Радиоактивностью называют самопроизвольное превращение неустойчивого изотопа одного химического элемента в изотоп другого элемента, сопровождающееся испусканием элементарных частиц или ядер.
Периодом полураспада (Т1/2) называется время, за которое распадается половина исходного количества радиоактивного изотопа.
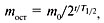
где: m0 – начальная масса вещества, mост – масса остатка, t – время процесса, Т1/2 – период полураспада.
К основным видам радиоактивного распада относятся:
1. α-распад (α -частица – ядро атома 42He). При испускании α -частицы ядро теряет два протона и два нейтрона, например:
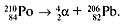
2. β–-распад (β–-частица – электрон). При испускании электрона заряд ядра увеличивается на 1, а массовое число не изменяется, например:
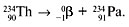
3. Позитронный (β+) распад (β+-частица – позитрон, обладает массой электрона и положительным зарядом). Число протонов в ядре при позитронном распаде уменьшается на 1, а массовое число не изменяется, например:
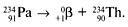
4. Электронный захват. При захвате ядром электрона заряд ядра уменьшается на 1, а массовое число остается прежним, например:
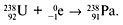
5. Спонтанное деление. Самопроизвольный распад тяжёлых ядер на два (редко – три или четыре) осколка – ядра элементов середины Периодической таблицы.
Уравнения ядерных реакций должны удовлетворять правилу равенства сумм индексов:
а) сумма массовых чисел частиц, вступающих в реакцию, равна сумме массовых чисел частиц – продуктов реакции;
б) сумма зарядов частиц, вступающих в реакцию, и сумма зарядов образовавшихся частиц – продуктов реакции – равны между собой.
