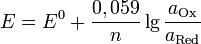Структура комплексного иона, образованного катионом металла и анионом ЭДТА
1) Монодентатные лиганды. Такие лиганды бывают нейтральными (молекулы Н2О, NH3, CO, NO и др.) и заряженными (ионы CN−, F−, Cl−, OH−, SCN−, S2O32− и др.).
2) Бидентатные лиганды. Примерами служат лиганды: ион аминоуксусной кислоты H2N — CH2 — COO−, оксалатный ион −O — CO — CO — O−, карбонат-ион СО32−, сульфат-ион SO42−.
3) Полидентатные лиганды. Например, комплексоны — органические лиганды, содержащие в своём составе несколько групп −С≡N или −COOH (этилендиаминтетрауксусная кислота — ЭДТА). Циклические комплексы, образуемые некоторыми полидентатными лигандами, относят к хелатным (гемоглобин и др.).
По природе лиганда
1) Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например: [Cu(NH3)4]SO4, [Co(NH3)6]Cl3, [Pt(NH3)6]Cl4 и др.
2) Аквакомплексы — в которых лигандом выступает вода: [Co(H2O)6]Cl2, [Al(H2O)6]Cl3 и др.
3) Карбонилы — комплексные соединения, в которых лигандами являются молекулы оксида углерода(II): [Fe(CO)5], [Ni(CO)4].
4) Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки. К ним относятся комплексные соли: K2[PtCl4], комплексные кислоты: H2[CoCl4], H2[SiF6].
5) Гидроксокомплексы — комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: Na2[Zn(OH)4], Na2[Sn(OH)6] и др.
Номенклатура
1) В названии комплексного соединения первым указывают отрицательно заряженную часть — анион, затем положительную часть — катион.
2) Название комплексной части начинают с указания состава внутренней сферы. Во внутренней сфере прежде всего называют лиганды — анионы, прибавляя к их латинскому названию окончание «о». Например: Cl− — хлоро, CN− — циано, SCN− — тиоцианато, NO3− — нитрато, SO32− — сульфито, OH− — гидроксо и т. д. При этом пользуются терминами: для координированного аммиака — аммин, для воды — аква, для оксида углерода(II) — карбонил.
4) Затем называют комплексообразователь, используя корень его латинского названия и окончание -ат, после чего римскими цифрами указывают (в скобках) степень окисления комплексообразователя.
K3[Fe(CN)6] — гексацианоферрат(III) калия
[Li(H2O)4]NO3 — нитрат тетрааквалития
Вопрос координационные соединения
Применение.
Образование координационных соединений используют в экстракционных и сорбционных процессах разделения и тонкой очистки редких, цветных и благородных металлов, в аналит. химии (см. Комплексонометрия, Комплексом). Координационные соединения применяют в качестве селективных катализаторов разл. процессов хим. и микробиол. пром-сти, для создания окислителей на основе фторидов галогенов и благородных газов, в качестве источников Н2 и О2 на основе гидридов и кислородсодержащих соед., в медицине, в т. ч. в терапии разл. видов опухолей, в качестве источников микроэлементов в животноводстве и с. х-ве, для получения тонких покрытий на разл. изделиях микроэлектроники и для придания антикоррозионных св-в и мех. прочности, и т. д.
В живых организмах координационные соединения присутствуют в виде витаминов, комплексов нек-рых металлов (в частности, Fe, Cu, Mg, Mn, Мо, Со) с белками и др. в-вами.
В организме непрерывно происходят образование и разрушение
биокомплексов из катионов биометаллов (железо, медь, цинк, кобальт) и
биолигандов (порфиринов, аминокислот, полипептидов). Обмен веществ с
окружающей средой поддерживает концентрации вещества на определенном
уровне, обеспечивая состояние металло-лигандного гомеостаза
Хелаты, хелатные соединения (от лат. chelate — клешня), также внутрикомплексные или циклические комплексные соединения — клешневидные комплексные соединения, образуются при взаимодействии ионов металлов с полидентатными (то есть имеющими несколько донорных центров) лигандами.
Иногда разделяют понятия хелатного и внутрикомплексного соединения. Второе определение применяют в случае, когда атом-комплексообразователь замещает протон лиганда в соединении.
Хелаты используют в химии для разделения, концентрирования и аналитического определения различных элементов. В медицине и сельском хозяйстве - для введения в пищу микроэлементов (Fe, Cu, Mn и т.д.), благодаря высокой усваиваемости хелатных комплексов по сравнению со свободными ионами металлов.
44 вопрос Электро́дный потенциа́л Уравнение нереста
Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их.
Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически.
В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) встандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой как гальваническая ячейка всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Электричество вырабатывается вследствие различияэлектростатического потенциала двух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродов по отношению к электролиту.
равнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, истандартными электродными потенциалами окислительно-восстановительных пар.
Вывод уравнения Нернста
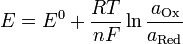
где
§ 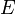 — электродный потенциал,
— электродный потенциал,
§ 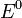 — стандартный электродный потенциал, измеряется в вольтах;
— стандартный электродный потенциал, измеряется в вольтах;
§ 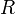 — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
§ 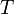 — абсолютная температура;
— абсолютная температура;
§ 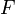 — постоянная Фарадея, равная 96485,35 Кл·моль−1;
— постоянная Фарадея, равная 96485,35 Кл·моль−1;
§ 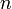 — число моль электронов, участвующих в процессе;
— число моль электронов, участвующих в процессе;
§ 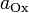 и
и 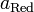 — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант 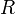 и
и 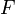 и перейти от натуральных логарифмов к десятичным, то при
и перейти от натуральных логарифмов к десятичным, то при 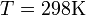 получим
получим