Коррозия и защита металлов от коррозии
Коррозией называется процесс химического и электрохимического разрушения металлов под воздействием окружающей среды.
Химическая коррозия происходит при воздействии на металл сухих газов и растворов неэлектролитов – бензина, масел, мазута, спиртов и др. На поверхности металла образуется пленка из продуктов коррозии. Примером
химической коррозии служит окисление стали при высоких температурах. Железо взаимодействует с кислородом и образуется окалина.
Электрохимическая коррозия происходит при воздействии на металл растворов электролитов: воды, водных растворов солей, кислот, щелочей, расплавов солей и щелочей.
В этих условиях коррозию можно рассматривать, как работу множества микрогальванических элементов, возникающих на поверхности металла вследствие неоднородности металла или окружающей среды.
Коррозия металлов в атмосфере, почве и других агрессивных средах арматурной стали и бетона, имеет свои особенности.
Атмосферная коррозия.В сухой атмосфере окисление металла происходит медленно и существенного его разрушения не происходит. При воздействии дождя, снега, водяного пара, при эксплуатации конструкций в воздухе с повышенной влажностью скорость коррозии становится высокой. Степень агрессивности атмосферы может повыситься в десятки и сотни раз при воздействии загрязненного воздуха. Например, срок службы проводов связи в сельской местности составляет 50–60 лет, в местах расположения промышленных предприятий (металлургических и химических заводов), электростанций уменьшается до 4–5 лет. В среде дымовых газов скорость коррозии достигает 0,4–0,8 мм в год. Особенно высокую агрессивность имеет атмосфера с содержанием сернистого газа. При взаимодействии его с водой воздуха образуется серная кислота, которая быстро разрушает углеродистые стали и защитные цинковые покрытия. Более долговечны алюминиевые сплавы.
Коррозия железа во влажной атмосфере происходит в результате образования ржавчины xFeO · yFe2O3 × ZгН2О в виде рыхлого осадка, который не защищает металл от дальнейшего разрушения и коррозия может продолжаться до полного разрушения металла.
Способ защиты металла выбирается в каждом отдельном случае. Повышенную коррозионную стойкость имеют легированные стали с добавкой хрома, никеля, меди. Углеродистые стали защищаются лакокрасочными и металлическими покрытиями, смазками.
Почвенная коррозия.Почвенной коррозии подвергаются трубопроводы, шпунты, различные опоры. Она определяется составом почвы, грунтовых вод, температурой и пр. Скорость коррозии углеродистой стали может достигать 7-8 мм в год. Усиливают коррозию бактериальные процессы. Особенно опасны сульфатредицирующие бактерии, которые восстанавливают сульфатные соли в почвах. Коррозионная стойкость конструкций повышается при применении сталей, легированных хромом и никелем.
Цинк корродирует в почвах, особенно в почвах с кислой реакцией. И все же цинковое покрытие - достаточно эффективная защита стальных конструкций от электрохимической коррозии.
Алюминий и его сплавы разрушаются щелочами. Однако при рН 10-11 скорость уменьшается и в интервале от рН 10–11 до рН 3–4 скорость коррозии остается постоянной.
Защищают от почвенной коррозии конструкции из углеродистой стали металлическими, силикатными, лакокрасочными покрытиями, обрабатывают почву замедлителями коррозии. Защита от блуждающих токов осуществляется дренажной защитой, заключающейся отводом их в источник, создающий эти токи. При наличии агрессивных микроорганизмов применяют изолирующие покрытия, добавляют в почву яды.
Коррозия арматурной стали в железобетоне.Одним из существенных недостатков железобетона является коррозия арматурной стали. Она носит преимущественно электрохимический характер и протекает на границе металл-раствор элекролита.
Поровое пространство бетона частично заполнено водой с растворенными в ней солями, щелочами, газами, т. е. является электролитом, способным проводить электрический ток. Свободная часть заполнена воздухом.
|
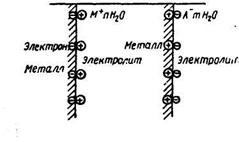
 По современным представлениям металл состоит из ион-атомов Ме+, связанных с электронами е, способными перемещаться внутри кристаллической решетки от одного атома к другому. Преодолеть электростатическое притяжение электронов, вырваться из кристаллической решетки и оторваться от поверхности металла ион-атом может только при наличии необходимой энергии. Эта энергия возникает в результате реакции гидратации (рисунок 18.30).
По современным представлениям металл состоит из ион-атомов Ме+, связанных с электронами е, способными перемещаться внутри кристаллической решетки от одного атома к другому. Преодолеть электростатическое притяжение электронов, вырваться из кристаллической решетки и оторваться от поверхности металла ион-атом может только при наличии необходимой энергии. Эта энергия возникает в результате реакции гидратации (рисунок 18.30). Электроны не переходят в раствор, и на поверхности металла остается их эквивалентное количество
Ме∙е + nН2О ® Ме + nН2О + е.
|
|
 |
|
Коррозионный процесс заключается в растворении металла. Избыточные электроны на поверхности металла ассимилируются ионами, атомами или молекулами электролита (деполяризаторами), которые при этом восстанавливаются:
е + D ® De.
