Следовательно, внешние электроны удерживаются слабее, и металлические (восстановительные) свойства элементов усиливаются, неметаллические (окислительные) - ослабевают.
Периодический закон Д. И. Менделеева
Марта 1869г. Формулировка периодического закона Д.И. Менделеева.
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Современная формулировка периодического закона.
Свойства химических элементов и их соединений находятся в периодической зависимости от величины заряда ядер их атомов, выражающейся в периодической повторяемости структуры внешней валентной электронной оболочки.
Основные положения
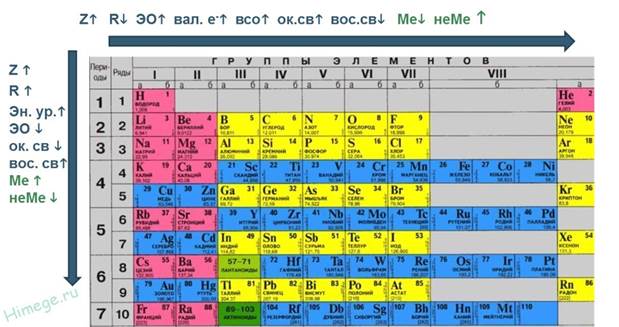
1. В периоде слева направо:
1) Относительная атомная масса – увеличивается
2) Заряд ядра – увеличивается
3) Количество энергоуровней – постоянно
4) Количество электронов на внешнем уровне - увеличивается
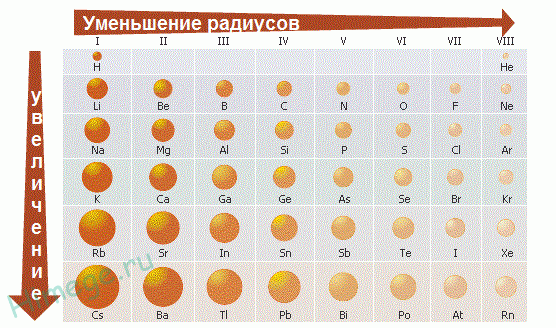
5) Радиус атомов – уменьшается
6) Электроотрицательность – увеличивается
Следовательно, внешние электроны удерживаются сильнее, и металлические (восстановительные) свойства ослабевают, а неметаллические (окислительные) усиливаются.
2. В группе, в главной подгруппе сверху вниз:
1) Относительная атомная масса – увеличивается
2) Число электронов на внешнем уровне – постоянно
3) Заряд ядра – увеличивается
4) Количество энергоуровней – увеличивается
5) Радиус атомов - увеличивается
6) Электроотрицательность – уменьшается.
Следовательно, внешние электроны удерживаются слабее, и металлические (восстановительные) свойства элементов усиливаются, неметаллические (окислительные) - ослабевают.
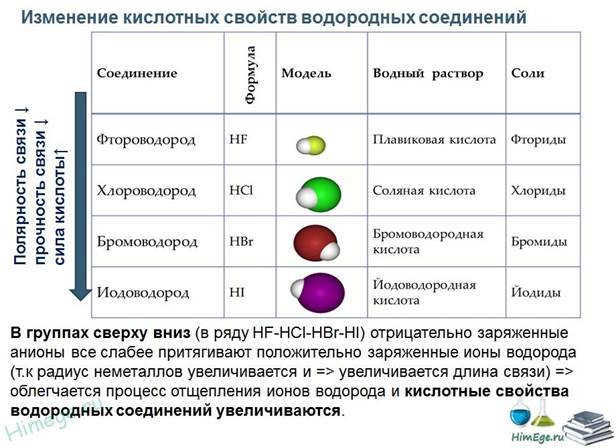
3. Изменение свойств летучих водородных соединений:
1) в группах главных подгруппах с ростом заряда ядра прочность летучих водородных соединений уменьшается, а кислотные свойства их водных растворов усиливаются (основные свойства уменьшаются);
2) в периодах слева направо кислотные свойства летучих водородных соединений в водных растворах усиливаются (основные уменьшаются), а прочность уменьшается;
3) в группах с ростом заряда ядра в главных подгруппах валентность элемента в летучих водородных соединениях не изменяется, в периодах слева направо уменьшается от IV до I.
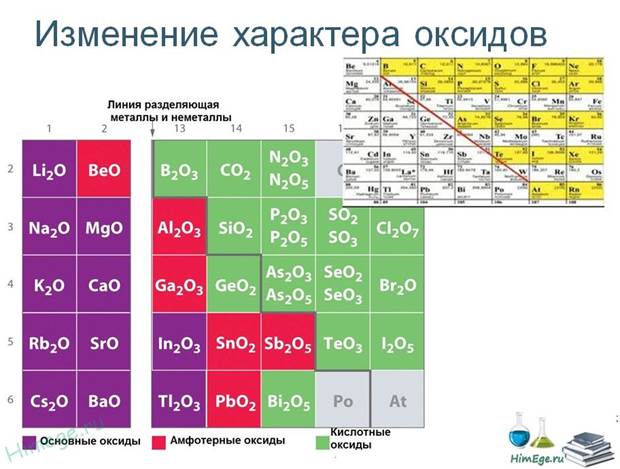
4. Изменение свойств высших оксидов и соответствующих им гидроксидов (кислородсодержащие кислоты неметаллов и основания металлов):
1) в периодах слева направо свойства высших оксидов и соответствующих им гидроксидов изменяются от основных через амфотерные к кислотным;
2) кислотные свойства высших оксидов и соответствующих им гидроксидов с ростом заряда ядра в периоде усиливаются, основные уменьшаются, прочность уменьшается;
3) в группах главных подгруппах у высших оксидов и соответствующих им гидроксидов с ростом заряда ядра прочность растёт, кислотные свойства уменьшаются, основные усиливаются;
4) в группах с ростом заряда ядра в главных подгруппах валентность элемента в высших оксидах не изменяется, в периодах слева направо увеличивается от I до VIII.
5. Завершенность внешнего уровня – если на внешнем уровне атома 8 электронов (для водорода и гелия 2 электрона)
6. Металлические свойства – способность атома отдавать электроны до завершения внешнего уровня.
7. Неметаллические свойства - способность атома принимать электроны до завершения внешнего уровня.
8. Электроотрицательность – способность атома в молекуле притягивать к себе электроны 
9. Семейства элементов:
Щелочные металлы (1 группа «А») – Li, Na, K, Rb, Cs, Fr
Галогены (7 группа «А») – F, Cl, Br, I
Инертные газы (8 группа «А») – He, Ne, Ar, Xe, Rn
Халькогены (6 группа «А») – O, S, Se, Te, Po
Щелочноземельные металлы (2 группа «А») – Ca, Sr, Ba, Ra
10. Радиус атома – расстояние от ядра атома до внешнего уровня