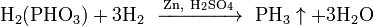Соединения фосфора с металлами
С активными металлами фосфор образует солеобразные фосфиды, подчиняющиеся правилам классической валентности. р-Металлы, а также металлы подгруппы цинка дают и нормальные, и анионоизбыточные фосфиды. Большинство из этих соединений проявляют полупроводниковые свойства, т.е. доминирующая связь в них - ковалентная. Отличие азота от фосфора, обусловленное размерным и энергетическим факторами, наиболее характерно проявляется при взаимодействии этих элементов с переходными металлами. Для азота при взаимодействии с последними главным является образование металлоподобных нитридов. Фосфор также образует металлоподобные фосфиды. Многие фосфиды, особенно с преимущественно ковалентной связью, тугоплавки. Так, АlР плавится при 2197 град.С, а фосфид галлия имеет температуру плавления 1577 град.С. Фосфиды щелочных и щелочно-земельных металлов легко разлагаются водой с выделением фосфина. Многие фосфиды являются не только полупроводниками (АlР, GаР, InР), но и ферромагнетиками, например СоР и Fе3Р.
Фосфи́н (фосфористый водород, гидрид фосфора, по номенклатуре IUPAC — фосфан РН3) — бесцветный, очень ядовитый, довольно неустойчивый газ со специфическим запахом гнилой рыбы.
Бесцветный газ. Плохо растворяется в воде, не реагирует с ней. При низких температурах образует твердый клатрат 8РН3·46Н2О. Растворим в бензоле, диэтиловом эфире, сероуглероде. При −133,8 °C образует кристаллы с гранецентрированной кубической решёткой.
Молекула фосфина имеет форму тригональной пирамиды c молекулярной симметрией C3v (dPH = 0.142 нм, HPH = 93.5o). Дипольный момент составляет 0,58 D, существенно ниже, чем у аммиака. Водородная связь между молекулами PH3 практически не проявляется и поэтому фосфин имеет более низкие температуры плавления и кипения.
Фосфин сильно отличается от его аналога аммиака. Его химическая активность выше, чем у аммиака, он плохо растворим в воде, как основание значительно слабее аммиака. Последнее объясняется тем, что связи H-P поляризованы слабо и активность неподелённой пары электронов у фосфора (3s2) ниже, чем у азота (2s2) в аммиаке.
В отсутствие кислорода при нагревании разлагается на элементы:
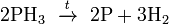
на воздухе самопроизвольно воспламеняется (в присутствии паров дифосфина или при температуре свыше 100 °C):
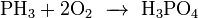
Проявляет сильные восстановительные свойства:
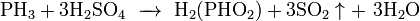
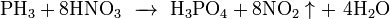
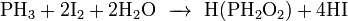
При взаимодействии с сильными донорами протонов фосфин может давать соли фосфония, содержащие ион PH4+ (аналогично аммонию). Соли фосфония, бесцветные кристаллические вещества, крайне неустойчивы, легко гидролизуется.
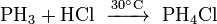
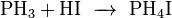
Как и сам фосфин, так и его соли являются сильными восстановителями.
Получают фосфин при взаимодействии белого фосфора с горячей щёлочью, например:
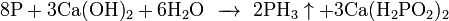
Также его можно получить воздействием воды или кислот на фосфиды:
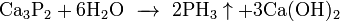
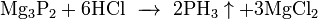
Возможен синтез непосредственно из элементов:
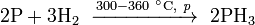
Хлористый водород при нагревании взаимодействует с белым фосфором:
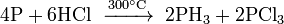
Разложение йодида фосфония:
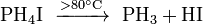

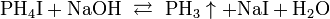
Разложение фосфоновой кистоты:
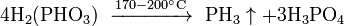
или её восстановление: