Робота № 11/2. Електрорушійні сили концентраційних елементів
Мета роботи. На основі виміряних ЕРС концентраційних ланцюгів обчислити дифузійні потенціали і числа переносу іонів H+ та Cl-.
Методика роботи. Електричні ланцюги, в яких обидва електроди є однаковими за своєю природою, але відрізняються активністю одного або декількох компонентів, що беруть участь в електродних процесах, називаються концентраційними ланцюгами (елементами). Електрична енергія в цих елементах виникає за рахунок вирівнювання концентрацій речовин. Концентраційні елементи поділяють на елементи:
- з перенесенням іонів;
- без перенесення іонів.
Концентраційними ланцюгами без перенесення іонів є елементи:
а) з однаковими електродами, які відрізняються концентраціями окиснених або відновлених форм речовин, але між розчинами відсутній безпосередній контакт;
б) з електродами із двох сплавів (амальгам), однакових за природою, але з різними концентраціями, які занурені в один і той самий електроліт;
в) з газовими електродами, однаковими за, природою, але з різними тисками газів і з одним розчином електроліту.
Нижче наведено приклади концентраційних елементів типів а-ві реакцій, що протікають під час їх роботи:
Тип а. (-) Zn | ZnCl2(aq) | AgCl, Ag, AgCl | ZnCl2(aq) | Zn (+), (1)
a'± a''±
причому a'± > a''±.
При роботі елемента (1) на електродах протікають такі реакції:
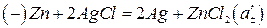 (2)
(2)
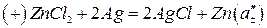 (3)
(3)
----------------------------------------------------
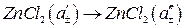 [сумарний процес], (4)
[сумарний процес], (4)
де a'±, a''± - середньоіонні активності ZnCl2. Електрична енергія в розглянутому елементі виникає за рахунок вирівнювання концентрації ZnCl2 у правій та лівій частині елемента.
Тип б. (-) Zn – Hgx | ZnSO4 | Zn – Hgy (С1 > С2) (+) (5)
С1 С2
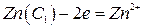 (6)
(6)
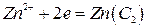 (7)
(7)
-------------------------------
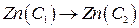 . (8)
. (8)
Тип в. Н2, Pt | HCl(aq) | Рt, Н2, (9)
P1 P2
причому Р1 > Р2.
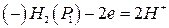 (10)
(10)
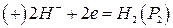 (11)
(11)
--------------------------------
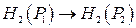 (12)
(12)
ЕРС цього газового концентраційного елемента без перенесення виникає за рахунок вирівнювання тиску водню на обох електродах і обчислюється за рівнянням:
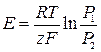 ;
; 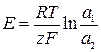 (13)
(13)
Концентраційними елементами з перенесенням іонів називаються елементи з однаковими електродами, але електроліти мають різні концентрації і між ними існує безпосередня межа поділу. Звичайно на межі поділу двох рідин розміщують пористі перетини, щоб уповільнити змішування розчинів. На межі поділу двох рідких фаз виникає дифузійний потенціал за рахунок різної рухливості іонів при їх переміщенні з більш концентрованого в менш концентрований розчин. Прикладом концентраційного елемента з перенесенням іонів може бути елемент
Ag | AgNO3(aq) | | AgNO3(aq) | Ag, (14)
a'± φD a''±
де a'± > a''±.
Дифузія AgNO3 відбувається зліва направо. Оскільки рухливість аніона NO3- є більшою, ніж катіона Ag+, то аніони перетинають межу поділу між розчинами швидше, ніж катіони. При цьому ліворуч від межі поділу з'являються надлишковий позитивний, а праворуч - негативний заряд. Тому на межі двох розглянутих розчинів виникає подвійний електричний шар.
При віддаленні від межі поділу рідких фаз у глиб розчинів концентрації іонів вирівнюються за рахунок їх теплового руху і дифузійний потенціал поступово зменшується та на деякій відстані стає рівним нулю.
Для зменшення дифузійного потенціалу на межі поділу розчинів електролітів розміщують сольовий місток, який являє собою U-подібну трубку, заповнену агар-агаром і витриману в насиченому розчині KCl або NH4NO3. Зменшення дифузійного потенціалу пояснюється тим, що рухливості іонів вказаний солей є близькими: 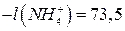 ;
; 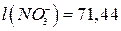 ;
; 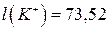 ;
; 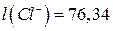 .
.
Дифузійний потенціал та ЕРС концентраційних елементів розраховують за рівняннями:
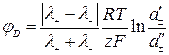 , (15)
, (15)
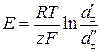 . (16)
. (16)
Порядок роботи.
1. Приготувати три розчини соляної кислоти.
2. Зібрати концентраційні елементи виду:
Ag | AgCl, HCl – HCl – HCl, AgCl | Ag (I)
1 н 1 н 0,1 н
Ag | AgCl, HCl – HCl – HCl, AgCl | Ag (II)
1 н 1 н 0,01 н
Ag | AgCl, HCl – HCl – HCl, AgCl | Ag (III)
0,1 н 0,1 н 0,01 н
та виміряти ЕРС, які включають дифузійні потенціали.
3. Щоб переконатися в можливості усунення дифузійних потенціалів, необхідно в ланцюгах (І-III) використовувати як з'єднувальну рідину не розчини соляної кислоти, а насичений розчин хлориду калію. Наприклад, ланцюг (І) матиме такий вигляд:
Ag | AgCl, HCl – KCl – HCl, AgCl | Ag (IV)
1 н нас 0,1 н
Одержані дані записати в таблицю.
| Елемент | Е, В | Елемент | Е, В | φD, В |
| I | IV | |||
| II | V | |||
| III | VI |
Обчислити величини дифузійних потенціалів як різницю між Е та Е’.
4. З одержаних величин φD розрахувати числа переносу іонів Н+ та Cl- згідно з формулою (14).
Література: [26, с. 123,143,148; 27, с. 94-106, 114-116].
