У методі кислотно-основного титрування стежать за зміною потенціалу водневого електрода у процесі титрування розчину сильної кислоти розчином сильної основи.
У методах оксредметрії в кінцевій точці титрувння (к.т.т.) спостерігається стрибок потенціалу, величина якого залежить від різниці відповідних двох оксред-систем, до яких відноситься титрована речовина (Відн) і титрант (Ок).
У методах осадження і комплексоутворення використовують електроди І,ІІ і ІІІ роду, а також відповідні йонселективні електроди.
3. Аналітична якісна реакція – це реакція , яка супроводжується певним зовнішнім ефектом (випад. осаду, утв забарвл розчину, розчин осаду, виділення газу).
Способи:
- сухий (забарвл полум, вигот перлів бури, метод розтирання);
- мокрий (реакція між розчинами електролітів)
Умови:
- певне рН;
- температура;
- концентрація;
- наявність специфічних реагентів та реакцій;
- присутність сторонніх йонів. Та їх вплив на проходження реакції.
Умови випливають із властивостей речовин, які вступають у реакцію.
Білет №15.
1.Потенціометричне титрування. Стрибок потенціалу в точці еквівалентності. Розрахунки та побудова кривої титрування.
2.Рівновага в розчинах слабких електролітів Закон розбавляння Оствальда. Концентраційна та термодинамічна константи дисоціації. Фактори, що впливають на них.
3.Визначення вмісту NaOH та Na2CO3 у суміші методом кислотно-основного титрування: хімізм, розрахункові формули.
4.Визначення Т(KMnO4/сіль Мора), якщо молярна концентрація еквівалента KMnO4 дорівнює 0,0220 моль/дм3.







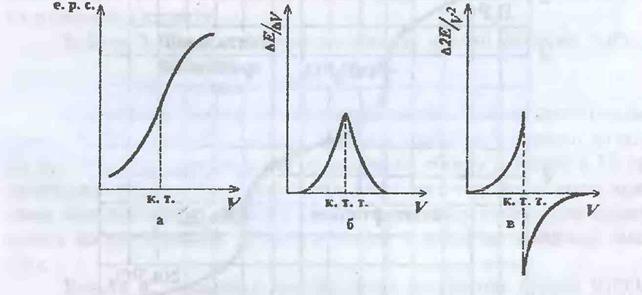
Закон розбавляння Оствальда. Із зменшенням концентрації електроліту(розбавлянням розчину) ступінь дисоціації його збільшується.
Між костантою та ступенем електолітичної дисоціації є зв'язок, відомий під назвою закон розбавляння Оствальда. Запишемо рівняння дисоціації слабкого бінарного електроліту КА:
Нехай його концентрація дорівнює С моль/дм3, а ступінь дисоціації α.Тоді концентрації йонів
[K+]=[A-]=C α, а концентрація недисоційованих молекул [KA]=C(1- α).
Підставивши значення концентрацій усіх частинок електроліту у вираз константи дисоціації, матимемо: Кдис=([K+][A-])/[KA]= (C α C α)/ C(1- α), або Кдис= C α2/1-α. Це рівняння є математичним виразом закону розбавляння. Припускаючи, що розбавлення V-це обєм розчину, що містить 1 моль речовини,то рівняння можна записати як
Кдис= α2/V(1-α).
Якщо електроліт є дуже слабким, тобто α<<1, то рывняння спрощуэться, а вираження закону розбавляння матиме вигляд Кдис=α2С звідси α=√Кдис/С (увесь дріб під корнем)
де Кдис-константа дисоціації, α-ступінь електролітичної дисоціації, С –концентрація.
Константа електролітичної дисоціації.Оскільки електролітична дисоціація слабких електролітів є зворотнім процесом, то вона підпорядковується закону дії мас. Отже, процес дисоціації слабких електролітів можна записати константу рівноваги. Як приклад розглянемо дисоціацію слабкого електроліту КА: КА↔ K++A- Позначимо концентраці йонів як [K+] та[A-], а концентрацію недисоційованих молекул через [KA]. Тоді константу рівноваги запишемо так К=([K+][A-])/[KA]
Константу рівноваги реакції дисоціації слабкого електроліту К називають константою дисоціації Кдис .
Вона, як і ступінь дисоціації є кількісно. Мірою здатності речовини дисоціювати в розчині. Що менше значення Кдис , то слабкішим є електроліт, і навпаки, що більше значення Кдис ,то краще дисоціює розчинена речовина. Константи дисоціації не залежать від концентраціє розчину, а залежать від температурри. Для двойонних електролітів вона має розмірність концентрації моль на літр(моль/л). З рівноваги слабкого електроліту КА↔ K++A-випливає, що збільшення концентрації в розчині одного з йонів K+ та A- введенням у розчин електролітуКА речовини, що містить одноіменний йон(K+чи A-), зміщує цю рівновагу ліворуч(принцип Ле Шательє). Тому якщо до розчину оцтової кислоти добавити розчин натрій ацетату, то концентрація молекул непродисоційованої кислоти збільшиться. Крім того, розбавлення розчину слабкого електроліту сприяє його дисоціації. Ступінь дисоціації при цьому збільшується , а значення Кдис лишається незмінним.
Слабкі електроліти, що складаються більш ніж з двох цонів, дисоціюють ступінчасто(постадійно). Кожний ступінь дисоціації характеризується певною величиною константи дисоціації. Ці константи дисоціації називаюься ступінчастими(стадійними) і позначаються К1, К2, К3…, Кn.(приклад H3PO4).
Замість стадійних констант для вираження константи електролітичної дисоціації часто використовують її десятковий логарифм, узятий із протилежним знаком, тобто pКдис=-lgКдис.
Слабкі електроліти в розчинах дисоціюють частково. До них належить більшістьь органічних кислот і основ, неорганічні кислоти H2CO3 H2S H2SiO3 HCN HF HOCl HNO2 ТА ОСНОВА NH4OH. Слабкими електролітами є галогеніди меркурію, плюмбуму, а також багато комплексних йонів, наприклад [Fe(CN)6]4- [Fe(CN)6]3- [HgI4]2- та ін.
Характерною особливістю слабких електролітів в розчинах є встановлення динамічної рівноваги між йонами і молекулами розчиненої речовини
СН3СООН↔СН3СОО- + Н+.
Із зменшенням концентрації розчину рівновага змішується праворуч, тобто дисоціація кислоти посилюється . а отже, збільшується ступінь електролітичної дисоціації.
Величина ступеня дисоціації електроліту крім хімічної природи речовини залежить також від природи розчинника.




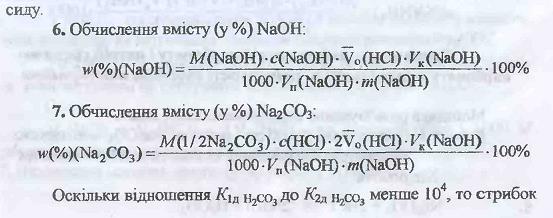

Розв*язання:
Т(KMnO4/сільМора)=(C(1/5KMnO4)*ME((NH4)2SO4FeSO46H2O))/1000=(0,0220*391,82)/1000=0,008620(г/дм3)
Білет 16
- Хроматографічні методи у аналітичній хімії
Хроматографія (від грецького слова "хроматос" - колір) - це метод розділення і аналізу сумішей речовин, який грунтується на різному розподілі їх між двома фазами, які не змішуються - рухомою і нерухомою При контакті з поверхнеюнерухомої фази (НФ) компоненти суміші розподіляються міжрухомою фазою (РФ) і НФ у відповідності з їх властивостями (адсорбцією, розчинністю тощо). Встановлюється динамічна рівновага, внаслідок чого компоненти досліджуваної суміші речовин частину часу знаходяться у НФ, а частину - у РФ Вздовж хроматографічної системи рухаються лише ті компоненти, які перебувають у РФ. Складові компоненти суміші володіють різною спорідненістю до РФ і НФ. Речовина, яка сильніше взаємодіє з НФ, буде повільніше рухатися через хроматографічну систему у порівнянні з речовиною, яка слабше взаємодіє з цією фазою
Для розділення різних речовин НФ повинна мати хоч би одну з чотирьох основних властивостей. !) фізично сорбуватя речовини, які знаходяться у РФ; 2) хімічно сорбувати речовини, які знаходяться у РФ; 3) розчиняти речовини, які розділяють, 4) мати пористу структуру і тому утримувати одні речовини і не затримувати інші, залежно від їх розмірів і форми
Сорбція — це поглинання речовини (сорбату) твердими або рідкими поглиначами (сорбентами). Розрізняютьадсорбцію - концентрування речовини на поверхні розділення фаз (адсорбенту) іабсорбцію -поглинання речовини або газової суміші об'ємом твердого тіла або рідини.
Якщо НФ є рідина і досліджувана речовина здатна в ній розчинятись, то вона розподіляється між РФ і НФ Така хроматографічна система називається розподільною Коли НФ - тверда речовина, здатна адсорбувати визначувану речовину, хроматографію називають адсорбційною.
Залежно від агрегатного стану фаз, типу взаємодії і оформлення розрізняють види хроматографії, представлені у таблиці 23.
Залежно від способу розміщення НФ є колонкова і тонкошарова хроматографія. У відповідності з режимом уведення проби у хроматографічну систему розрізняють фронтальну, елюентну і витиснювальну хроматографію. Якщо розчинну суміш безперервно вводять у хроматографічну колонку, то в чистому вигляді можна виділити лише одну речовину, яка найслабше сорбується Всі решта вийдуть з колонки у вигляді сумішей. Цей метод називається фронтальним В елюентному
режимі пробувводятьу потікРФ (елюент). СкладРФ (елюента) до і після введення залишається незмінним.У процесі руху по колонці компоненти суміші розподіляються на зони Ці зони почергово виходять із колонки, розділені зонами чистого елюентаУ витиснювальному методі після введення проби і попереднього розділення слабкоактивним елюентом склад елюента змінюється таким чином, що він взаємодіє зНФсильніше кожного з компонентів аналізованої суміші. Внаслідок цього новий елюент витиснює компоненти, які виходять з колонки в послідовності зростання взаємодії зНФ У цьому методі зони окремих компонентів змішані.
Таблиця 23
Основні види хроматографії
| Вид | РФ | НР | Форма | Механізм |
| розподілення | ||||
| Газова | ||||
| газо-адсорбціина | Г* Е | т Л. | К IV | Адсорбційний |
| газо-рідина | Г | р | к | Розподільний |
| Рідинна | ||||
| твердо-рідинна | Р | Т | к | Адсорбційний |
| рідинно-рідинна | Р | р | к | Розподільний |
| йоно-рідинна | Р | т | к | Ионний обмін |
| Тонкошарова | Р | т | Тонкий шар | Адсорбційний |
| Р | р | Тонкий шар | Розподільний | |
| Паперова | Р | р | Листок | Розподільний |
| паперу | ||||
| Ситова (гель- | Р | р | К | За розміром |
| проникаюча | молекул |
Г - газ; Р - рідина; Т - тверда, К - колонка
Найпоширеніший елюентний режим хроматографування, який дозволяє одержати в чистому вигляді всі компоненти проби В рідинній хроматографії використовують також ізократичний і градієнтний режими подачі елюента. В ізократичному режимі склад елюента протягом аналізу не змінюється, у градієнтному режимі склад елюента змінюється за певною програмою.
Йонообмінна хроматографія є різновидністю рідинної хроматографії і в апаратурному оформленні нічим не відрізняється від інших видів рідинної колонкової хроматографії В основі методу іонообмінної хроматографії лежить реакція обміну йонами між розчином і сорбентом.
Сорбентами використовують спеціальні синтетичні смоли або мінеральні речовини - йонообмінники, які містять активні групи, здатні до обміну йонами з розчином. Йонообмінники є катіоніти (обмінюють катіони) і аніоніти (обмінюють аніони) Катіоніти здатні до обміну катіонів. Залежно від функціональних груп, які беруть участь у йонному обміні, катіоніти поділяють на сильнокислотні (містять групи -SО 3 Н),
СереДНЬОКИСЛОТНІ (з групою ортофосфатної КИСЛОТИ –PО3-Н+ ) і
слабкоісислотні (-СОО-Н ). Випускають катіоніти в Н-формі або в сольовій (протийони Ка+, К+).
Аніоніти здатні обмінювати аніони. Сильноосновні аніоніти
містять четвертинну амонієву групу -N(СН3)з,+ середньо- і слабкоосновні містять вторинні або третинні протоновані аміногрупи -NН(СН3)2+, -NH2(СНз)3 Випускають аніоніти в ОН-формі (йонообміяником є гідроксид-йон) або в СІ-формі (сольова форма).
Амфоліти можуть обмінюватися як з катіонами, так і з аніонами. Такі диполярні йонообмінники можна одержати, зв'язуючи з матрицею амінокислоти, наприклад, аргінін.
Хелатні смоли можуть зв'язувати метал-йони, утворюючи з ними різної міцності комплекси. Одержують такі йоніти, вводячи в матрицю здатні до комплексоутворення функціональні групи (наприклад, залишки цитратної чи тартратної кислоти, ЕД'ГА та інші ліганди, які утворюють лабільні комплекси з метал-йонами) Можливе введення в йоніт груп, селективно взаємодіючих лише з невеликим числом йонів. Наприклад, смоли з групами –СН2-SН селективно зв'язують метал-йони, утворюючи малорозчинні сульфіди
Загальною властивістю всіх йоштів є їх можливість відокремлювати електроліти від неелектролітів. Вимоги до йонообмінників, які використовують у хроматографічному аналізі: 1) не розчиняються в рухомій фазі, 2) стійкі до дії кислот і основ, 3) містять достатню кількість йоногенних труп, 4) досить механічно мщш
Важливою характеристикою йоштів є їх обмінна ємність. Повна обмінна ємність визначається числом труп, які беруть участь в обміні і які припадають на 1 г сухого йоніту, відмитого від сторонніх сорбованих речовин Ємності йонообмінників, які випускає промисловість, знаходяться в межах 1-10 ммоль екв/г Для катіонообмінників ємність оцінюється за числом катіонів, для аніонітів - за аніонами, для амфотерних йонів – окремо за йонами двох видів..
Ємність сшіьнокислотних і сильноосновних йонітів не залежить від рН середовища, в якому проходить йонний обмін. Для слабкокис- лотних і слабкоосновних йонітів ємність сильно залежить від рН розчину, а також від концентрації і природи йонів, які обмінюються. Ємність слабких йоштів визначається числом йонізованих при даній кислотності розчину функціональних груп. Порівняти ємності двох слабких йонітів можна лише за строго визначених умов (кислотність, температура і т.п.). Чим більша обмінна ємність, тим більшу пробу можна ввести в колонку , не допускаючи "проскакування" йонів Тому одним із видів обмінної ємності є ємність до "проскакування", яка визначається експериментально за появою цього йона у рухомій фазі, яка витікає з колонки.
В йонообмінній хроматографії рухомою фазою використовують водні буферні розчини. Змінюючи концентрацію гідроген йонів. вид буферу і йонну силу, можна змінити селективність системи. Слабкі кислоти і основи знаходяться в йонізованому стані при певному значенні рН середовища Тому від, концентрації гідроген(1+)-йонів в елюенті залежить, чи будуть брати участь ці сполуки в йонному обмші чи пройдуть через колонку у вигляді недисоційованих молекул. Значення рН елюента має вплив і на обмінну ємність слабких йонітів, збільшуючи або зменшуючи число йонних центрів, здатних до обміну. На ємність йоніту має вплив йонна сила елюенту. Присутність сторонніх йонів зміщує рівновагу йонного обміну за участю визначуваного йона, в результаті чого утримування цього йона йонообмінником зменшується
При розділенні метал-йонів на хелатних смолах, регулюючи рН, також можна підвищити селективність системи. При підвищенні кислотності розчину зв'язуватися в комплекси з лігандами будуть лише ті метал-йони, які здатні до утворення міцних сполук.
Переважна більшість речовин може бути розділена і проаналізована за допомогою хроматографічних методів. В аналітичній хімії органічних сполук, яких у сотні тисяч разів більше, ніж неорганічних, хроматографія є ведучим методом. Для проведення хроматографічного аналізу використовують як найпростіші, так і досить складні прилади. Деякі види хроматографії (паперова, тонкошарова та ш.) не потребують якихось складних приладів, і комплект пристосувань для їх проведення може бути легко зібраний у будь-якій лабораторії. Більш складними є прилади для газової хроматографії, які серійно випускає промисловість Йонообміїшу хроматографію широко використовують для аналізу
органічних сполук, які йонізують (кислоти, аміни, амінокислоти, компоненти нуклеїнових кислот і т.п.) Для аналізу амінокислот створені автоматичні аналізатори, які у процесі хроматографування змінюють рН елюента, йонну силу, вводять необхідні реагенти.
Одержання катіоніту або аніоніту. Для проходження реакцій обміну катіоніти повинні містити Н -йони, які здатні обмінюватися на катіони, тобто катіоніт повинен бути в Н-формі, а аніоніти повинні бути в ОН- або СІ-формі, тобто містити ОН~- чи СГ-йони, які здатні обмінюватися на аніони. Загальний вигляд рівняння реакції йонного обмілу для катюнообмінника:
nRSO-3H+ +Mn+ -- (RSO3)nM + nH+ ,
а для аніонообмінника:
nR4N+ OH-+ Аn- -- (R4N)nА + пOH-
деRSO-3 і R4N+ - високомолекулярні аніон і катіон
При відсутності побічних реакцій (гідролізу, полімеризації тощо) процес йонного обміну стехіометричний V цьому основна відмінність йонообмінної хроматографії від молекулярної адсорбційної і розподільної.
Переводять йонообмінники в Н- чи ОН-форму обробкою сорбен- та розчином НС1 чи ИаОН Катіоніти замочують при перемішуванні розчином НСI з масовою часткою речовини НСI 3% протягом 12 год, а потім промивають дистильованою водою. Аніоніти замочують на 12 год розчином НСI з масовою часткою речовини НСI 3%, а потім промивають дистильованою водою. Якщо необхідно одержати гідроксидну форму, хлоридну форму обробляють протягом 2-4 год розчином NaОН з масовою часткою речовини NаОН 2%, а потім промивають дистильованою водою.
Підготовка катіонітної колонки. Приготовленим сорбентом заповідають хроматографічну колонку (рис. 52) Пhи цьому на дно колонки кладуnь ватний тампон або скляну пластинку. Колонку заповнюють дистильованою водою, а потім змивають з колби в колонку сорбент, слідкуючи, щоб між частинками сорбента не попали пухирці повітря Коли шар сорбента досягне висоти 8-10 см, заповнення зупиняють і поверх шару сорбента поміщають ватний тампон. Сорбент промивають у колонні дистильованою водою до нейтральної реакції води, яка витікає з колонки, і приступають до хроматографування
Методика хроматографування. Через колонку пропускають
точний об'єм (5-Ю см3) ішалізованиіо розчину зі швидкістю витікання рідини 20-25 крапель за 1 хв. Після внесення в колонку аналізованого розчину, колонку промивають дистильованою водою до нейтральної реакції, збираючи промивні води в колбу для титрування.
Проведення титрування. Весь зібраний елюат титрують з мікробюрет- ки (бюретки) кислотою або лугом. Кількість речовини еквівалента титран- ту еквівалентна кількості речовини еквівалента, яку аналізують.
Регенерація йонообмінника.Через колонку з катюнітсм пропускають розчин НС1 з масовою часткою речовини НС1 3%, а через колонку з аніонітом - розчин КаОН з масовою часткою речовини 2%. При цьому відбувається відновлення Н- і ОН-форм йонообмінників. Приклад; рівняння реакції регенерації йонообмінника:
(RSO-3)nM + nH+ --- nRSO-3H+ +Mn+
