СПИСОК РЕКОМЕНДОВАНОЇ ЛІТЕРАТУРИ. 1. Ахметов Н.С. Общая и неорганическая химия / Н.С
1. Ахметов Н.С. Общая и неорганическая химия / Н.С. Ахметов – М: Высш. шк., 1998. – 743 с.
2. Григор’єва В.В. Загальна хімія / В.В. Григор’єва, В.М. Cамійленко. – К.: Вища шк.., 1991. – 431 с.
3.Хімія / Емельянов Б.М. , Бердов Г.І., Бондар О.О., Шилюк П.С. – К.: Фенікс, 2010. - 456с.
4. Некрасов Б.В. Основы общей химии. В 2-х т. / Б.В. Некрасов. – М.: Химия, 1973, Т-1 – 656 с.; Т.2 – 149 с.
5. Загальна та неорганічна хімія. – В-2-х т. / О.М. Степаненко, Л.Г. Рейтер, В.М. Медовських, С.В. Іванов. – К.: Педагогічна преса, 2002, Т. 1 – 54 с; Т. 2 – 149 с. – 31 с.
6. Романова Н.В. Загальна та неорганічна хімія. / Романова Н.В. – К.: Ірпінь, ВТФ ’’Перун’’, 2004-420 с.
7. Глинка Н.Л. Общая химия / Н.Л. Глинка – Л.: Химия, 1988. – 702 с.
8. Айкин Г.Л. Задачи и упражнения по общей химии./ Г.Л. Айкин. – М: Высш. шк., 1971.– 51 с.
Додаток 1
ТИСК ВОДЯНОЇ ПАРИ РН2О ЗА РІЗНИХ ТЕМПЕРАТУР
| to C | Р н2о | to C | Р н2о | ||
| кПа | мм рт. ст | кПа | мм рт. ст | ||
| 1,23 1,31 1,40 1,49 1,60 1,70 1,82 1,94 2,06 2,20 2,34 | 9,21 9,84 10,51 11,23 11,99 12,79 13,63 14,53 15,48 16,48 17,54 | 2,49 2,64 2,81 2,98 3,17 3,36 3,56 3,78 4,00 4,24 4,50 | 18,65 19,83 21,07 22,38 23,76 25,21 26,74 28,35 30,04 31,82 33,79 |
Додаток 2
ЧИСЛОВІ ЗНАЧЕННЯ ДЕЯКИХ КОНСТАНТ
| Константа | Символ | Числове значення |
Абсолютна температура
плавлення льоду Т пл. льоду 273,15 К
Атомна одиниця маси а.е.м. 1 а.е.м. = 1/12 (12о)=
= 1,66∙10-27 кг
Універсальна газова стала R 8,314 Дж/(моль∙к)
62360 мм рт.ст.∙см3/(моль∙К)
0,082 атм∙л/(моль∙К)
Стала Авогадро NA 6,02253∙1023 моль-1
Молярний об’єм за нормальних
умов (Т=273 К, p=101325 Па) VМ 22,414 л/моль
Швидкість світла у вакуумі С 2,9979∙10-8 м/с
Константа Планка h 6,625∙10-34 Дж∙с
Заряд електрона qe 1,6021∙10-19 Кл
Маса спокою електрону me 9,109∙109-31 кг
Боровський радіус ro 5,29167∙10-11 м
Константа Фарадея F 96487 Кл/моль
Константа дисоціації води
при температурі 20 оС КдН2О 1,8∙10-16
Іонний добуток води при
температурі 20 оС К Н2О 10-14
Взаємозв’язок одиниць різних систем
1 атм = 760 рт.ст = 101325 Па
1 эв = 23,6 ккал/моль = 96,483 кДж/моль
1 ккал = 4,1868 кДж; 1 кДж = 0,239 ккал
1 кд = 3∙10-11 ел.ст.од. = Є; 1 е.е.з. = 1,6021∙10-19 Кл
Перетворення деяких кратних і дольних одиниць
ех = 2,3 lgx; 1 м = =10-10 Ао
1м = 10-3 км = 102 см = 103 мм = 106 мкм = 109 нм = 1012 пм
1 кг = 10-3 т = 103 г = 106 мг = 10-9 мкг
1 м3 = 103 дн3 (103 л) = 106 см3 (106 мл).
Додаток 3
ТЕРМОДИНАМІЧНІ ВЛАСТИВОСТІ ДЕЯКИХ РЕЧОВИН
| Формула речовини | Агрегат- ний стан | ∆Но,кДж/ (моль∙К) | So, Дж/ (моль∙К) | Формула речовини | Агрегат- ний стан | ∆Но,кДж/ (моль∙К) | So, Дж/ (моль∙К) |
| NH3 | г | -46,19 | 192,50 | MgCO3 | т | -1112,94 | 65,69 |
| O2 | г | 205,03 | Mg(NO3)2 | т | -789,604 | 164,012 | |
| NO | г | +86,69 | 210,20 | MgO | т | 1574,98 | 130,54 |
| N2 | г | 191,49 | CaSO4· 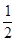 H2O H2O | т | -601,826 | 26,77 | |
| NO2 | г | +33,852 | 240,454 | CaSO4∙2H2O | т | -2033,67 | 193,97 |
| H2O | г | -241,83 | 108,72 | CaSiO3 | т | -1584,06 | 82,006 |
| CO | г | -110,52 | 197,91 | CaCO3 | т | -1206,87 | 92,08 |
| CO2 | г | -393,51 | 213,64 | CaO | т | - 635,55 | 39,75 |
| CH4 | г | - 74,85 | 186,19 | Са(OH)2 | т | -986,587 | 76,148 |
| N2 | г | 130,547 | NaHCO3 | т | -947,68 | 102,09 | |
| С2H6 | г | -235,308 | 52,655 | Na2CO3 | т | -1130,93 | 135,98 |
| C2H4 | г | + 52,28 | 19,45 | AgNO3 | т | -123,135 | 140,91 |
| H2S | г | - 20,146 | 205,643 | Ag | т | 42,70 | |
| SO2 | г | - 296,86 | 248,53 | SiO2 | т | 859,393 | 41,84 |
| S2 | г | 31,88 | NH4Cl | т | -315,39 | 94,5 | |
| HCl | г | -92,31 | 86,779 | Fe2O3 | т | -821,3 | 90,0 |
| Сl2 | г | 222,96 | Fe | т | 27,15 | ||
| FeO | т | -263,7 | 58,8 | ||||
| H2O | ж | -285,84 | 69,94 | 3CaO∙SiO2 | т | -3826,9 | 2 11,01 |
| C2H5OH | ж | -277,67 | BeCO3 | т | -981,57 | 199,4 | |
| BeO | т | 570,24 | 14,24 | ||||
| ZnO | т | -347,98 | 43,93 | 2BeO∙SiO2 | т | - 2160,0 | 64,48 |
| Zn | т | 41,63 | BeO∙SiO2 | т | -1453,45 | 54,0 | |
| Al2O3 | т | -1675,0 | 50,94 | ||||
| Mg(OH)2 | т | -925,99 | 63,22 | Al | т | 28,31 | |
| ВaO | т | -556,6 | 70,3 | ||||
| BaCO3 | т | -1202,0 | 112,1 |
Додаток 4
СТАНДАРТНІ ІЗОБАРНІ ПРОЦЕСИ ДЕЯКИХ РЕЧОВИН
| Речовина | ∆Go утв., 298 | Речовина | ∆Go утв., 298 | ||
| кДж/моль | ккал/моль | кДж/моль | ккал/моль | ||
AgF (k)- 186,0 - 44,5KCl (k)- 707,8 - 97,66
AgCl (k)- 109,5 - 26,2 KCl (p)- 413 - 98,88
AgBr (k) - 194,9 - 22,7 KBr (k) - 379,7 - 90,6
AgI - 66,3 - 15,85 KI(k) - 321,9 - 77,0
Al(OH)3 (k) - 1138,6 - 272,4 KNO3 (p)- 392,5 - 93,9
βAl2O3 (k)1580 - 378,0 KOH (p) - 439,3 - 105,1
As2O3 (k)- 568,5 - 136,0 K2CrO4 (k) - 1284,9 - 307,4
As2O3 (k) - 771,2 - 183,5 K2SO4 (k)- 1315,0 - 314,6
BaCO3 (k) - 1137,8 - 272,8 K2SO4 (p)- 1305,0 - 312,2
BaO (k)- 527,5 - 126,2 MgCO3 (k) - 1028,3 - 246,0
BaCl2 (p)- 810,0 - 193,8 MgO (k) - 568,9 - 136,1
BaSO4 (k) - 1352,8 - 323,4 Mg(OH)2 (k) 833,1 - 199,3
BaSO4 (p) - 1311,2 - 313,3 MgSO4 (k)- 1172,5 - 280,5
CF4 (r) - 634,7 - 151,85 NH3 (r)- 16,7 - 4,0
CCl4 (r)- 63,95 - 15,3 NH4NO3- 173,3 - 43,86
CBr4 (r) 35,9 8,6 NO (r) 86,8 20,76
CI (r) 125,4 30 NO2 (r) 51,8 12,4
CO (r) 138,1 - 32,8 Na (k)- 539,2 - 129,0
CO2 (r) - 393,96 - 94,25 NaCl (k) - 383,1 - 91,9
CaCO3 (k)- 1128,8 - 269,8 NaCl (p) - 392,5 - 83,9
CaO (k) - 603,4 - 144,35 NaBr (k) - 348,6 - 83,4
Ca(OH)2 (k) - 1118,4 - 267,33 NaI (k) - 285,1 - 68,2
CaSO4 (k) - 1319,2 - 315,6 NaNO3 (p) - 367,8 - 89,0
Закінчення додатка 4
Cl2O3 (k) 401,3 96 NaOH (k)- 380,4 - 91,0
CrO3 (k) - 505,8 - 121,0 Na2O (k) - 376,2 - 90,0
Cr2O3 (k) -1058,0 - 253,15 Na2SO4 (p) -1260,3 - 302,5
CuSO4 (p)- 676,4 161,81 NiCl2 (k) - 258,7 - 61,9
FeCl2 (k) - 303,5 - 72,6 Ni(OH)2 (k) -452,7 - 108,3
Fe(OH)2 (k) -473,1 - 115,57 OH- (p) -147,2 - 37,6
Fe(OH)3 (k) - 693,9 - 166 H3P (r)12,5 3
FeS (k)97,5 23,32 P4O10 (k) -2735,4 - 654,4
HgCl2 (k)- 183,9- 44,0PbCl2 (k) -313,9 - 75,06
HF (r) -269,6 - 54,5 PbO (k) - 188,5 - 45,1
HCl (r)- 95,1 - 22,75 SO2 (r)- 300,1 - 71,79
HBr (r)- 58,3 - 12,8 SO3 (r)- 370,1 - 88,52
HI (r)1,3 0,3 SnO (k) -256,7 -61,4
H2O (r)- 228,2 - 54,635 SnO2 (k) - 519,6 - 124,3
H2O (ж)- 237,2 - 56,72 Ta2O5 (k)-1908,2 - 456,5
H2S (r)- 33,3 - 7,96 TiCl2 (k) -468,8 - 112,5
H2Se(r)71,1 17,0 TiCl4 (k) - 752,4 -180,0
H2Fe (r)138,4 33,1 TiO2 (k)- 887,8- 212,4
HNO3 (p) -110,4 - 26,4 ZnO (k)- 318,1 - 76,1
H2SO4 (r)- 741,1 - 177,3 ZrO2 (k)-1035,6 - 247,75
H2SO4 (ж)- 689,4 - 164,94 ZnS (k) - 239,8 - 57,4
H3PO4 (k)- 1118,2 - 267,5 ZnSO4 (k) - 870,7 - 280,31
ZnSO4 (p)- 888,3 - 212,52
Додаток 5
РОЗЧИННІСТЬ СОЛЕЙ ТА ОСНОВ У ВОДІ ЗА ТЕМПЕРАТУРИ 18OC
(в грамах безводної солі на 100 г Н2О)
| Аніон | К а т і о н | ||||||||||
| К+ | Na+ | Li+ | Ag+ | Ti+ | Ba2+ | Sr2+ | Ca2+ | Mg2+ | Zn2+ | Pb2+ | |
| Cl - | 33,0 | 35,9 | 77,8 | 1,3∙103 | 0,9 | 37,2 | 51,1 | 79,2 | 55,8 | 1,49 | |
| Br - | 65,9 | 88,8 | 168,7 | 1∙10-5 | 0,042 | 103,6 | 96,5 | 143,3 | 103,1 | 0,598 | |
| І- | 137,5 | 177,9 | 161,5 | 3,5∙10-7 | 6∙10-3 | 169,2 | 148,2 | 0,08 | |||
| F- | 92,6 | 44,4 | 0,27 | 195,4 | 72,1 | 0,16 | 0,012 | 1,6∙10-3 | 8,7∙10-3 | 5∙10-3 | 0,06 |
| NO3 - | 30,3 | 84,0 | 71,4 | 8,91 | 8,74 | 66,3 | 121,8 | 74,3 | 117,8 | 51,7 | |
| ClO3 - | 6,6 | 97,2 | 12,25 | 3,69 | 35,74 | 174,9 | 179,3 | 126,4 | 183.9 | 150,6 | |
| BrO3 - | 6,38 | 36,7 | 152,5 | 0,59 | 0,30 | 0,8 | 30,0 | 85,2 | 42,9 | 58,4 | 1,3 |
| IO3 - | 7,62 | 8,33 | 80,4 | 0,04 | 0,059 | 0,05 | 0,25 | 0,25 | 6,87 | 0,83 | 2∙10-3 |
| OH - | 142,9 | 116,4 | 12,04 | 0,01 | 40,0 | 3,7 | 0,77 | 0,17 | 1∙10-3 | 5∙10-4 | 0,01 |
| SO42- | 11,11 | 15,83 | 35,6 | 0,55 | 4,74 | 2,3∙10-4 | 0,011 | 0,20 | 35,4 | 53,1 | 4,1∙10-3 |
| CrO4 2- | 63,1 | 16,2 | 11,6 | 2,5∙10-3 | 6∙10-3 | 3,5∙10-3 | 0,12 | 0,4 | 73,0 | - | 2∙10-5 |
| Cr2O7 2- | 30,3 | 3,34 | 7,22 | 3,4∙10-3 | 1,48 | 8,5∙10-3 | 4,6∙10-3 | 5,5∙10-4 | 0,03 | 6,4∙10-4 | 2,6∙10-4 |
| CO3 2- | 108,0 | 19,39 | 1,33 | 0,03 | 4,95 | 2,3∙10-3 | 1,1∙10-3 | 1,3∙10-3 | 0,1 | 4∙10-3 | 1∙10-4 |
Додаток 6
СТУПІНЬ ДИСОЦІАЦІЇ КИСЛОТ*, ОСНОВ І СОЛЕЙ В РОЗЧИНАХ З МОЛЯРНОЮ КОНЦЕНТРАЦІЄЮ 0,1 ЗА ТЕМПЕРАТУРИ 18 О С
| Електроліт | Формула | Ступінь дисоціації, % |
Кислоти
Хлорогідрогенна HCl 92
Бромогідрогенна HBr 92
Іодогідрогенна HІ 92
Нітратна HNO3 92
Сульфатна H2SO4 58
Сульфітна H2SO3 34
Фосфорна H3PO4 27
Фторогідрогенна HF 8,5
Ацетатна CH3COOH 1,3
Карбонова H2CO3 0,17
