Тепловой эффект любой реакции не зависит от промежуточных стадий, а определяется начальным и конечным состоянием системы
Легко пояснить закон Гесса с помощью следующего примера. Углекислый газ из углерода и кислорода можно получить двумя путями (рис. 6.2):
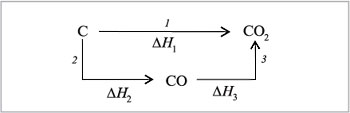 |
| Рис.6.2. Графическое истолкование закона Гесса на примере превращения углерода в углекислый газ |
1) в одну стадию – прямым сжиганием в избытке кислорода;
2) в две стадии – получением сначала монооксида углерода и его последующим сжиганием.
Согласно закону Гесса:  H1 =
H1 =  H2 +
H2 +  H3.
H3.
Из закона Гесса вытекают три важных следствия.
Следствие 1. Энтальпия реакции равна разности энтальпий образования продуктов и реагентов:
 Hр0 =
Hр0 = 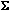
 Hf 0 (прод.) –
Hf 0 (прод.) – 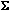
 Hf 0(реаг.).
Hf 0(реаг.).
Так, если уравнение реакции в общем виде записать следующим образом:
aа + bb = cc + dd,
то  Hр0 = c
Hр0 = c  Hf 0(I+ d
Hf 0(I+ d  Hf 0(D) – a
Hf 0(D) – a  Hf 0(A) – b
Hf 0(A) – b  Hf 0(B).
Hf 0(B).
Из первого следствия закона Гесса можно определить стандартную теплоту образования глюкозы, пользуясь энтальпией ее сгорания:
С6Н12О6 + 6О2 = 6СО2 + 6Н2О,
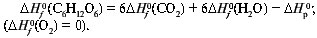
Следствие 2. Энтальпия реакции равна разности энтальпий сгорания реагентов и продуктов:
 Hр 0=
Hр 0= 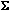
 Hсг0(реаг.) –
Hсг0(реаг.) – 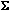
 Hсг0(прод.).
Hсг0(прод.).
Для реакции: aа + bb = cc + dd,
 Hр0 = a
Hр0 = a  Hсг0(А) + b
Hсг0(А) + b  Hсг0(B) – c
Hсг0(B) – c  Hсг0(C) – d
Hсг0(C) – d  Hсг0(D).
Hсг0(D).
Теплота сгорания –количество тепла, которое выделяется при сгорании 1 моль вещества с образованием высших оксидов.
Теплота сгорания берётся при нормальных условиях.
Следствие 3. Термохимические уравнения реакций можно складывать и вычитать, умножать и делить, записывать справа налево, несмотря на подчас практическую неосуществимость обратных реакций.
Это следствие приходит на помощь, когда соединения либо не удается получить при непосредственном взаимодействии простых веществ, либо они не горят. Так, сульфат кальция не получается при непосредственном смешении в калориметре кальция, кислорода и серы. В этой случае поступают следующим образом. Последовательно проводят четыре реакции, измеряя их тепловые эффекты (табл. 6.1). Энтальпия образования сульфата кальция из простых веществ будет равна сумме энтальпий четырех проведенных реакций.
Таблица 6.1 Суммирование уравнений реакций и энтальпий согласно третьему следствию из закона Гесса
| № | Уравнение реакции |  Hр Hр |
| Ca + 1/2O2 = CaO |  H1 H1 | |
| S + O2 = SO2 |  H2 H2 | |
| SO2 + 1/2O2 = SO3 |  H3 H3 | |
| CaO + SO3 = CaSO4 |  H4 H4 | |
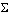 | Ca + S + 2O2 = CaSO4 |  Hp = Hp =  H1 + H1 +  H2 + H2 +  H3 + H3 +  H4 H4 |
Иногда вместо энтальпий реакций используют теплоты реакций, а вместо энтальпий образования веществ их теплоты образования. Теплоты реакций и теплоты образования связаны с соответствующими энтальпиями простым соотношением: Q = –  H.
H.
Первое начало термодинамики позволяет определить только энергетические характеристики (позволяет составить тепловые балансы химических процессов). Оно позволяет судить о направлении процесса.
